
某学习小组拟通过实验探究绿矾(FeSO4·7H2O)热分解的产物。
【实验前准备】
(1)理论分析 小组成员从理论上分析,认为下列分解产物不可能的是 。
a.Fe2O3、SO3、H2O b.Fe2O3、SO2、SO3、H2O
c.FeO、Fe2O3、SO2、SO3、H2O
(2)查阅资料 常压下SO3熔点16.8℃,沸点44.6℃
【实验探究】
针对以上可能的组合猜想,该学习小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
(3)实验过程
①仪器连接后,检查装置A与B气密性的操作为 。
②取一定量绿矾固体置于A中,通入N2以驱尽装置内的空气,关闭k,用酒精灯加热
双通管。
③观察到A 中固体逐渐变红棕色,B中试管收集到无色液体,C中溶液褪色。
④待A中反应完全并冷却至室温后,取少量反应后固体于试管中,加入硫酸溶解,取
少量滴入几滴KSCN溶液,溶液变红色。
⑤往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊。
( 4)实验结果分析
结论1:B中收集到的液体是 。
结论2:C中溶液褪色,可推知产物中有 。
结论3:综合分析上述实验③和④可推知固体产物一定有Fe2O3。
【实验反思】
(5)请指出该小组设计的实验装置的明显不足: 。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,
选用一种试剂鉴别,该试剂最合适的是 。
a.氯水和KSCN溶液 b.酸性KMnO4溶液 c. H2O2 d. NaOH溶液
(1) a (2分)
(3)①关闭K,向C中加水至浸没导管口,微热双通管,观察到C中导管口有气泡连续放出,表明AB装置气密性良好。
(4)H2SO4溶液 (2分) SO2 (1分)
(5)在C装置后增加一套尾气处理装置 (2分)
(6)b (2分)
解析试题分析:(1)加热FeSO4·7H2O发生氧化还原反应,氧化剂中有元素化合价降低,还原剂中有元素化合价升高,b、c项都有元素化合价的升高和降低,a中只有Fe元素化合价的升高,没有化合价的降低,故a项不可能。
(3)①利用加热时,气体体积膨胀检验装置的气密性,所以检查装置A与B气密性的操作为:关闭K,向C中加水至浸没导管口,微热双通管,观察到C中导管口有气泡连续放出,表明AB装置气密性良好。
(4)往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊,说明B中收集到的液体是H2SO4溶液;C中溶液时品红溶液褪色,说明加热FeSO4·7H2O有SO2产生。
(5)加热FeSO4·7H2O产生有毒的SO2,该装置没有尾气处理装置,所以应在C装置后增加一套尾气处理装置。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,Fe2+能使酸性KMnO4溶液褪色,所以最合适的为b项。
考点:本题考查氧化还原反应原理及应用、实验基本操作、物质和离子的检验、实验方案的设计及评价。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:实验题
现有镁条、铝粉、铜片、氧化铝、氧化铁、氯酸钾及其它常用的实验用品和仪器,根据现有药品,请你设计简单实验验证铝、铁金属单质的还原性强弱。依据你设计的实验方案,回答下列问题:
(1)实验原理:(用化学方程式表示) ;实验中所需的化学仪器为 。
(2)引发实验的操作方法为: 。
(3)实验探究:取少量反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象, (填能或否)说明固体混合物中无Fe2O3,并说明理由 (理由用离子方程式说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中Na2CO3的质量分数。
方案一:称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:________。
(2)实验中,需加热至恒重的目的是________。
方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO3—=BaCO3↓+H2O)
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为________。
(2)实验中判断沉淀是否完全的方法是________。
方案三:按如下图所示装置进行实验: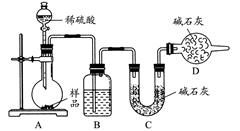
(1)D装置的作用是________。分液漏斗中________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.90 g样品,实验后测得C装置增重8.80 g,则样品中Na2CO3的质量分数为________。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷,该缺陷是________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学小组用下列装置对铁及其化合物的性质进行探究,回答有关问题:
(1)该小组同学想制得氢氧化亚铁并保存较长时间,按如图(a)所示装置对其进行操作。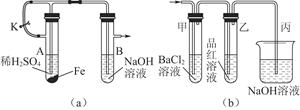
①某同学的操作是:先夹紧止水夹K,再使A管开始反应,实验中在B管中观察到的现象是
。
②为达到实验目的,正确的操作是 。
B管中发生反应的离子方程式是 。
(2)当上述装置的实验结束后,取A管内反应所得的溶液,隔绝空气小心蒸干后得到FeSO4,再高温煅烧(有关装置和操作均已略去),最后留下红棕色固体,将分解时产生的气体按图(b)所示装置依次通过洗气装置,结果试管甲内出现白色沉淀,试管乙内品红溶液红色褪去,回答:
①用方程式表示试管甲产生白色沉淀的原因
。
②为验证红棕色固体成分,可进行如下操作
。
③图(b)中丙装置的作用是 。
④根据实验现象写出A管内溶液蒸干后,在高温煅烧分解时所发生反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
【探究一】设计如图所示装置进行“铁与水反应”的实验。
(1)硬质玻璃管中发生反应的化学方程式为______________________________。
(2)反应前A中投放碎瓷片的目的是____________________________________。
(3)装置E中的现象是________________________________________________。
【探究二】设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
(4)待硬质玻璃管B冷却后,取少许其中的固体物质溶于_______后,将所得溶液分成两份。
(5)一份滴加几滴KSCN溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分(选填序号,下同)为_______;若溶液未变红色,推断硬质玻璃管B中固体物质的成分为_______。
①一定有Fe3O4 ②一定有Fe
③只有Fe3O4 ④只有Fe
(6)另一份用_______(填仪器名称)加入_______,可以证明溶液中存在Fe2+。
【探究三】设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。
(7)试剂b的化学式是_______。
(8)计算反应后B装置中铁元素的质量分数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
如图所示A管中装有Fe粉和适量的稀H2SO4,B管中装有足量的NaOH溶液。某同学用该装置制Fe(OH)2。完成下列填空:
(1)打开a,使A管中反应进行一段时间。
(2)夹紧止水夹a,在B管中可观察到的现象是: , B中发生反应的离子方程式为 。
(3)该同学进行(1)操作的目的 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
已知Fe2O3与H2反应会因温度不同而可能有Fe3O4生成。某化学兴趣小组在用H2还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X。为探究X的组成,他们进行了如下实验:
(1)甲同学认为黑色粉末X能被磁铁吸附,因此X是铁。但乙同学不同意他的结论,原因是___________________________。
(2)乙同学先将少量黑色粉末X加入装有足量硫酸铜溶液的烧杯中,振荡,固体部分溶解,有极少量红色物质析出,过滤;然后向滤渣中加入盐酸,再滴加几滴KSCN溶液,溶液出现红色。通过现象分析,丙同学得出X的组成是Fe和Fe3O4。
①滴加KSCN溶液的目的是_____________________。
②若将粉末X直接加入盐酸中,再加KSCN溶液,溶液不出现红色,则不出现红色的原因是(用离子方程式表示) _____________。
(3)丁同学的实验方案: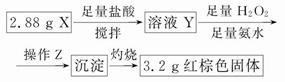
①操作Z是__________________。
②通过以上数据,得出2.88 g黑色粉末X中各成分的物质的量为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
现有NaHCO3和Na2CO3·xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量)。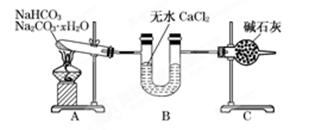
(1)A装置的作用:________________________________________________________________。
(2)B装置的作用是:_______________________________________________________________。
(3)C装置的作用是:_________________________________________________________________。
(4)若在装置A的试管中装入NaHCO3和Na2CO3·xH2O的混合物3.7 g,用酒精灯加热到反应完全,此时B管增重1.89g,C管增重0.22 g,则x的值为______。
(5)该装置还不是很完善,可能使测定结果偏小,应如何改进________。为什么?___________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
亚铁盐在空气中一般都易被氧化,而摩尔盐[(NH4)2SO4·FeSO4·6H2O]比一般的亚铁盐要稳定,但受热时易分解易被氧化。其实验室的制备原理为:FeSO4+(NH4)2SO4+6H2O=(NH4)2SO4·FeSO4·6H2O↓
如图为制取摩尔盐的简要流程: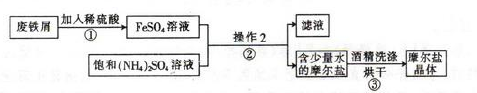
请回答下列问题:
(1)步骤①中反应容器应尽量避免摇晃或搅拌,目的是 。
(2)步骤②中的操作是加热蒸发、 、 。为什么不能加热蒸干? 。
(3)摩尔盐中NH4+、Fe2+、SO42-的检验:
①甲同学提出可以用湿润的 试纸、稀盐酸和 溶液来检验这三种离子。
②乙同学提出检验其中的Fe2+,可以用KSCN溶液和 ,预期的现象和结论是 。
③实际操作中,乙同学加人KSCN溶液时,发现溶液变成浅红色,于是他对自己的方法提出了怀疑。丙同学经过仔细思考认为,乙同学的方法是可行的,这是因为 。
(4)丁同学欲测定摩尔盐中Fe2+的含量。他称取了4. 0g摩尔盐样品,溶于水,并加入适量稀硫酸,用0.20mol/L的KMnO4溶液滴定,消耗KMnO4溶液10.00mL
①本实验的指示剂是 (填字母)。
| A.酚酞 | B.石蕊 | C.甲基橙 | D.不需要 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com