
【题目】完成下列填空
① 2—溴丙烷的消去反应(化学方程式)
② 1,2-二溴乙烷的水解(化学方程式)
③检验溴乙烷中溴元素滴加试剂顺序(填化学式)
④二氢香豆素(![]() )常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(
)常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(![]() )需要用到的试剂有:NaOH溶液、 。
)需要用到的试剂有:NaOH溶液、 。
【答案】
① ②方程式略 ③ 氢氧化钠、硝酸、硝酸银 ④ 硫酸,氯化铁或浓溴水
【解析】
试题分析:①2-溴丙烷在氢氧化钠的醇溶液中发生消去反应生成丙烯、溴化钠和水;反应的化学方程式为:CH3-CHBr-CH3+NaOH![]() CH3-CH=CH2↑+NaBr+H2O,故答案为:CH3-CHBr-CH3+NaOH
CH3-CH=CH2↑+NaBr+H2O,故答案为:CH3-CHBr-CH3+NaOH![]() CH3-CH=CH2↑+NaBr+H2O;
CH3-CH=CH2↑+NaBr+H2O;
②卤代烃在碱性水溶液加热条件下发生取代反应,由1,2-二溴乙烷变成乙二醇,生成乙二醇与溴化钠方程式为:CH2BrCH2Br+2NaOH![]() CH2OHCH2OH+2NaBr,故答案为:CH2BrCH2Br+2NaOH
CH2OHCH2OH+2NaBr,故答案为:CH2BrCH2Br+2NaOH![]() CH2OHCH2OH+2NaBr;
CH2OHCH2OH+2NaBr;
③证明溴乙烷中溴元素的存在,先发生加入氢氧化钠溶液并加热,发生水解反应生成NaBr,再加入稀硝酸至溶液呈酸性,最后加入硝酸银溶液,生成淡黄色沉淀,则证明含溴元素,即操作顺序为②③④①;溴乙烷与NaOH的乙醇溶液反应生成乙烯、溴化钠、和水,其化学方程式为:CH3CH2Br+NaOH![]() CH2=CH2↑+NaBr+H2O;加AgNO3后发生反应的离子方程式为:Ag++Br-=AgBr↓;溴乙烷水解需在碱性条件下进行,加入AgNO3溶液之前需加入稀硝酸酸化,否则溶液中的OH-会干扰Br-的检验,所以检验溴乙烷中溴元素滴加试剂顺序为NaOH、HNO3、AgNO3;故答案为:NaOH、HNO3、AgNO3;
CH2=CH2↑+NaBr+H2O;加AgNO3后发生反应的离子方程式为:Ag++Br-=AgBr↓;溴乙烷水解需在碱性条件下进行,加入AgNO3溶液之前需加入稀硝酸酸化,否则溶液中的OH-会干扰Br-的检验,所以检验溴乙烷中溴元素滴加试剂顺序为NaOH、HNO3、AgNO3;故答案为:NaOH、HNO3、AgNO3;
④二氢香豆素的水解产物中含苯酚结构,利用苯酚的性质鉴别,所以试剂除NaOH外,还选用稀硫酸中和至酸性,选氯化铁溶液显紫色检验苯酚,故答案为:稀硫酸和氯化铁溶液。


科目:高中化学 来源: 题型:
【题目】向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水)。以下推断正确的是


A. OA段产生的沉淀为BaSO4和Fe(OH)3
B. 据图计算原溶液中c(Cl-)=c(SO42-)
C. AB段可能发生的反应是:2SO42-+ 2Ba2++ Al3++3OH-=2BaSO4+Al(OH)3
D. C点溶液呈碱性的原因是AlO2-水解,其离子方程式为:AlO2-+2H2O=Al(OH)3+OH一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅氧化还原液流电池作为一种新型铅电池,具有一定的应用前景,正在逐渐成为电化学储能领域的一个研究热点。该电池以酸性甲基磺酸铅溶液为电解液,简化的工作原理如图所示,下列说法正确的是( )

A.放电时,H+经过循环泵向Pb电极移动
B.放电时,正极反应式为PbO2+4H++2e-=Pb2++2H2O
C.充电时,阴极反应式为2H++2e-=H2↑
D.该电解液可用稀H2SO4替代,放电效果相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法正确的是( )
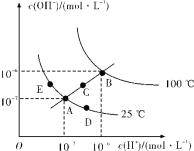
A.图中五点Kw间的关系:B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量NaOH的方法
C.若从A点到C点,可采用温度不变时在水中加入适量H2SO4的方法
D.100℃时,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃,将2 mol X和1 mol Y充入体积为1L的密闭容器中,已知:2X(g)+Y(g) ![]() 2Z(s)△H=-M kJ·mol-1。10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法正确的是 ( )
2Z(s)△H=-M kJ·mol-1。10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法正确的是 ( )
A. 在10 min时,X的反应速率为0.02 mol·L-1·min-l
B. 在0~10 min内,Y的反应速率为![]() mol·L-1·min-l
mol·L-1·min-l
C. 无法计算该温度下Y的平衡转化率
D. 反应达平衡后,保持T℃,通入稀有气体增加压强,则化学反应速率变快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示。下列说法错误的是( )
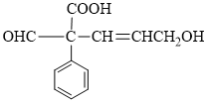
A.该有机物的分子式为C12H12O4
B.1 mol该有机物最多能与4 mol H2反应
C.该有机物可与NaHCO3溶液反应放出CO2,生成2.24 L CO2(标准状况下)需要0.1 mol该有机物
D.该有机物可发生氧化、取代、加成和还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1) m+n_________p(填“>”“=”“<”)。
(2)若加压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入A(体积不变),则B的转化率_________。
(4)若降低温度,则平衡时B、C的浓度之比![]() 将_________。
将_________。
(5)若加入催化剂,平衡时气体混合物的总物质的量___________。
(6)若B是有色物质,A、C均无色,维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊烯是生产精细化工产品的重要中间体,其制备涉及的反应如下:
氢化反应:![]() (l)+H2(g)
(l)+H2(g)![]()
![]() (环戊烯)(l) H=-100.5 kJ/mol
(环戊烯)(l) H=-100.5 kJ/mol
副反应:![]() (l)+H2(g)
(l)+H2(g)![]()
![]() (环戊烷)(l) H=-109.4 kJ/mol
(环戊烷)(l) H=-109.4 kJ/mol
解聚反应: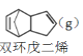
![]() 2
2![]() (g) H>0
(g) H>0
回答下列问题:
(1)反应![]() (l)+2H2(g)
(l)+2H2(g)![]()
![]() (l)的△H=_________ kJ/mol。
(l)的△H=_________ kJ/mol。
(2)一定条件下,将环戊二烯溶于有机溶剂进行氢化反应(不考虑二聚反应),反应过程中保持氢气压力不变,测得环戊烯和环戊烷的产率(以环戊二烯为原料计)随时间变化如图所示:
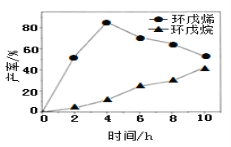
①0~4 h氢化反应速率比副反应快的可能原因是___________________。
②最佳的反应时间为_________h。若需迅速减慢甚至停止反应,可采取的措施有__________________(写一条即可)。
③一段时间后,环戊烯产率快速下降的原因可能是_____________________。
(3)解聚反应在刚性容器中进行(不考虑氢化反应和副反应)。
①其他条件不变,有利于提高双环戊二烯平衡转化率的是________(填标号)。
A.增大双环戊二烯的用量 B.使用催化剂 C.及时分离产物 D.适当提高温度
②实际生产中常通入水蒸气以降低双环戊二烯的温度(水蒸气不参与反应)。某温度下,通入总压为300 kPa的双环戊二烯和水蒸气,达到平衡后总压为500 kPa,双环戊二烯的转化率为80%,则 p(H2O)=________kPa,平衡常数Kp=__________kPa (Kp为以分压表示的平衡常数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com