
【题目】硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计了制备Na2S2O3·5H2O装置和部分操作步骤如下。
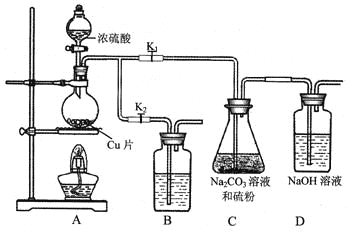
I.打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
II.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
当C中溶液的pH接近7时即停止C中的反应,停止加热。
III.过滤C中的混合液。
IV.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
①I中,圆底烧瓶中发生反应的化学方程式是_________。
②II中,“当C中溶液的pH接近7时即停止C中的反应”的原因是__________。
“停止C中的反应”的操作是___________。
③III中,“过滤”用到的玻璃仪器是(填仪器名称)___________。
④装置B中盛放的试剂是(填化学式)________溶液,其作用是__________。
(2)依据反应2S2O32-+I2=S4O2-6+2I-,可用I2的标准溶液测定产品的纯度。取5.5g产品,配制成100mL溶液。取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/LI2的标准溶液进行滴定,相关数据记录如下表所示。
编号 | 1 | 2 | 3 | 4 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
①判断达到滴定终点的现象是______________。
②Na2S2O3·5H2O在产品中的质量分数是(计算结果保留1位小数)_________。
(Na2S2O3·5H2O的式量为248)
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O Na2S2O3在酸性溶液中不能稳定存在 打开K2,关闭K1 漏斗、玻璃棒、烧杯 NaOH 在C中的反应停止后,吸收A中产生的多余SO2,防止空气污染 加入最后一滴I2标准溶液后,溶液变蓝,且半分钟内颜色不改变 90.2%
CuSO4+SO2↑+2H2O Na2S2O3在酸性溶液中不能稳定存在 打开K2,关闭K1 漏斗、玻璃棒、烧杯 NaOH 在C中的反应停止后,吸收A中产生的多余SO2,防止空气污染 加入最后一滴I2标准溶液后,溶液变蓝,且半分钟内颜色不改变 90.2%
【解析】
(1)浓硫酸具有强氧化性,在加热的条件下能氧化单质铜,反应的化学方程式是Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
生成的SO2和碳酸钠反应生成亚硫酸钠和CO2,由于Na2S2O3在酸性溶液中不能稳定存在,所以C中碳酸钠的作用是起反应物作用及提供碱性环境。“停止C中的反应”的操作是打开K2,关闭K1;
(2)过滤时的主要玻璃仪器有漏斗、烧杯、玻璃棒;
SO2是大气污染物,需要尾气处理,则装置B中盛放的试剂是氢氧化钠溶液,用来吸收SO2,防止污染环境;
(3)由于碘遇淀粉显蓝色,则滴定时,达到滴定终点的现象是溶液变蓝,且半分钟不改变。根据表中数据可知,第二次实验中消耗I2标准溶液的体积偏小,舍去,则实际消耗I2标准溶液的体积的平均值是![]() ,则根据反应的方程式可知,Na2S2O3·5H2O的物质的量是0.050mol/L×0.0200L×2×10=0.02mol,所以Na2S2O3·5H2O在产品中的质量分数是
,则根据反应的方程式可知,Na2S2O3·5H2O的物质的量是0.050mol/L×0.0200L×2×10=0.02mol,所以Na2S2O3·5H2O在产品中的质量分数是![]() 。
。


科目:高中化学 来源: 题型:
【题目】已知:298K时,Ksp(MnS)=4.65×10-14,Ksp(MnCO3)=2.24×10-11。298K时,MnS、MnCO3在水中沉淀溶解平衡曲线如图所示。下列说法正确的是( )

A.图像中e点处溶液c(Mn2+)≈5.0×10-6
B.常温下,加水稀释X溶液可使d点转移到f点
C.其他条件不变,加热含Y固体的Y溶液可使e点升到f点
D.在MnS和MnCO3饱和溶液中加少量MnCl2,![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应A2(g)+2B2(g)===2AB2(g)(AB2的分子结构为B—A—B)的能量变化如图所示,下列有关叙述中正确的是( )

A. 该反应是放热反应
B. 该反应的ΔH=-(E1-E2) kJ· mol-1
C. 该反应中反应物的键能总和大于生成物的键能总和
D. 由2 mol A(g)和4 mol B(g)形成4 mol A—B键吸收E2 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100molL-1的NH4SCN溶液滴定25.00mL0.100molL-1AgNO3溶液,以NH4Fe(SO4)212H2O为指示剂,测得溶液中pSCN=lgc(SCN-)、pAg=lgc(Ag+)随加入NH4SCN溶液的体积变化如图所示。已知:Ag++SCN-AgSCN↓,Ksp(Ag2SO4)=1.4×10-5。下列说法错误的是( )

A.滴定至终点时溶液颜色变为红色,且振荡后不褪色
B.该温度下AgSCN的溶度积常数Ksp=1.0×10-12
C.为防止指示剂失效,溶液应维持酸性
D.当加入15.00mLNH4SCN溶液时,溶液中c(SO42-)=0.14molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物是药物生产的中间体,其结构简式如图。下列有关叙述正确的是( )

A. 该有机物能与溴水发生加成反应
B. 该有机物与浓硫酸混合加热可发生消去反应
C. 1 mol 该有机物与足量NaOH溶液反应最多消耗3 mol NaOH
D. 该有机物经催化氧化后能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是元素周期表的一部分,根据所给的10种元素,完成以下各小题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
2 | C | N | O | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)镁的原子结构示意图为___。
(2)H2SO4与HClO4中,酸性较强的是___。
(3)NaOH与Al(OH)3中,属于两性氢氧化物的是___。它常用作治疗胃酸(含盐酸)过多的药物,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 W、X、Y、Z位于三个不同的周期,W与Y同主族,X 与 Z 的核外电子数之和是Y的核外电子数的2倍。化合物甲的结构式如图所示,甲不溶于水。下列说法正确的是( )
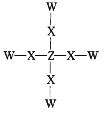
A.简单离子半径:Y>X
B.非金属性:Z>X
C.化合物甲中每个原子都达到了8电子稳定结构
D.由 W、X、Y 三种元素形成的化合物的水溶液能与 Z 的单质反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组采用电渗析法从含NH4H2PO4 和(NH4)2HPO4的废水中回收NH3·H2O和 H3PO4,装置如图所示。下列说法错误的是( )
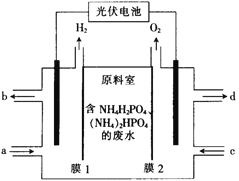
A.膜1为阳离子交换膜,膜2为阴离子交换膜
B.a处进入稀氨水,d处流出浓H3PO4溶液
C.阴极区总反应式为2H2O+2NH4++2e-=2NH3·H2O+H2↑
D.每放出11.2L(标准状况)H2时,能回收98gH3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A为电源,B为浸透饱和食盐水和酚酞的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液如图所示。

(1)闭合K1 ,断开K2 ,通电后,d端显红色,则电源a端为______极,若c、d为惰性电极,c端的电极反应是____________________________________
检验c端产物的方法_______________________________________________
高锰酸钾液滴现象__________________________________________________
(2)已知C装置中溶液的溶质为Cu(NO3)2和X(NO3)3 ,且均为0.1 mol,断开K1,闭合K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示,则Cu2+、X3+、H+ 氧化能力由大到小的顺序是_______;

(3)D装置中反应的方程式 ___________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com