
��һ���¶���,������X������Y��0.16 mol����10 L�����ܱ�������,������ӦX(g)+Y(g) 2Z(g)����H<0,һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±�:
2Z(g)����H<0,һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±�:
����˵����ȷ����(����)
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.��Ӧǰ2 min��ƽ������v(Z)=2.0��10-3 mol��(L��min)-1
B.������������,�����¶�,��Ӧ�ﵽ��ƽ��ǰv(��)>v(��)
C.���¶��´˷�Ӧ��ƽ�ⳣ��K=1.44
D.������������,�ٳ���0.2 mol Z,ƽ��ʱX�������������
 Ӧ������ҵ��ϵ�д�
Ӧ������ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NA��ʾ�����ӵ�������ֵ������������ȷ����
A����⾫��ͭʱ����ת����NA�����ӣ�����������32 gͭ
B����״���£�33.6 L���������к���1.5 NA�������������
C��1mol Cl2�����������Ӧ��ת��3NA������
D��1 mol FeCl3��ˮ��Ӧ����ȫת��Ϊ����������������н������ӵ���ĿΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
H���Ǹ�һ�۵������ӣ�������NH3�������·�Ӧ��H��+NH3�� H2+NH2���������й������Ӧ��˵���в���ȷ����
A. �÷�Ӧ��NH3����ԭ B.�÷�Ӧ��H���ǻ�ԭ��
C.�÷�Ӧ��NH2���ǻ�ԭ���� D.��Ӧ�б������ͱ���ԭ��Ԫ�ض���HԪ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����κ�һ��ƽ����ϵ�����´�ʩ��һ����ʹƽ���ƶ����ǣ� ��
A������һ�ַ�Ӧ�� B�������¶�
C����ƽ����ϵ����ѹǿ D��ʹ�ô���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҵ���Ʊ����跴Ӧ���Ȼ�ѧ����ʽ���£�
SiCl4(g)��2H2(g) Si(s)��4HCl(g) ��H����Q kJ��mol��1(Q>0)
Si(s)��4HCl(g) ��H����Q kJ��mol��1(Q>0)
ij�¶ȡ�ѹǿ�£���һ������Ӧ��ͨ���ܱ������������Ϸ�Ӧ������������ȷ���� (����)
A����Ӧ�����У�������ѹǿ�����SiCl4��ת����
B������Ӧ��ʼʱSiCl4Ϊ1 mol������ƽ��ʱ����������ΪQkJ
C������Ӧ���¶���T1������T2����Ӧ��ƽ�ⳣ��K1>K2
D������Ӧ����Ϊ0.25QkJʱ�����ɵ�HClǡ����1 molNaOH��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
CO�ǶԻ���Ӱ��ϴ�����壬�����ĺ������ƺ��������Ż��������滷������Ч;����
��1����ҵ����CO��H2��ԭ�Ͽ��Ժϳɼ״�����ΪҺ��ȼ�ϡ���֪��
�� 2H2(g)��CO(g)��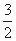 O2(g) = 2H2O(g)��CO2(g) ��H1= -594.1kJ/mol
O2(g) = 2H2O(g)��CO2(g) ��H1= -594.1kJ/mol
�� 2CH3OH(l)��3O2(g) = 4H2O(g)��2CO2(g) ��H2 = ��1452kJ/mol
��д����CO(g)��H2(g)�ϳ�1molҺ̬�״����Ȼ�ѧ��Ӧ����ʽ��___________��
��2��һ���¶��£����ݻ�Ϊ2L�ĺ��������м���3mol H2��2mol CO������Ӧ2H2(g)��CO(g)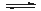 CH3OH(g)�ﵽƽ��ʱ����������ڵ�ѹǿ�Ƿ�Ӧǰѹǿ��
CH3OH(g)�ﵽƽ��ʱ����������ڵ�ѹǿ�Ƿ�Ӧǰѹǿ��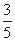 ���ݴ˼�����¶��·�Ӧ��ƽ�ⳣ����д���̣���
���ݴ˼�����¶��·�Ӧ��ƽ�ⳣ����д���̣���
��3���ں��º��ݵ������£���2���ﵽƽ�����������ͨ��CO(g)��CH3OH(g)��ʹ��CO(g)��CH3OH(g)Ũ�Ⱦ�Ϊԭƽ���2������ƽ�� ��
A��������Ӧ�����ƶ� B�����淴Ӧ�����ƶ�
C�����ƶ� D�����ж��Ƿ��ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����(HF)��һ�����ᡣ25��ʱ����20mLO.1mol•L-1������м���VmL0.1mol•L-1NaOH��Һ��ַ�Ӧ����֪: HF(aq)+OH-(aq)�TF-(aq)+H2O(1) ��H= - 67.7kJ•mol-1��
H+(aq)+OH-(aq)�TH2O (1) ��H�T - 57.3kJ•mol- �������⣬�����жϻ������ȷ����
A.�����ĵ�����������ȵ�
B.��V=20ʱ����Һ��:c(F-)��c(Na+)=0.1mol•L-1
C.��V��20ʱ����Һ������Ũ�ȹ�ϵ����Ϊ:c(Na+)=c(F-)
D.��V��20ʱ����Һ������Ũ�ȹ�ϵһ��Ϊ:c(Na+)��c(F-)��c(OH-)��c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���н���������;������ķ�Ӧ����ʽ��ȷ����
A��������������γɻ��漰��Ӧ��2H2SO3+O2 2H2SO4
2H2SO4
B���ȵĴ�����Һ������ϴ���۵�ԭ��CO32�� +2H2O
 H2CO3+2OH¯
H2CO3+2OH¯
C��ʢ��NaOH��Һ���Լ�ƿ�����ò�������SiO2+2OH¯=SiO32��+H2O
D���ɷ�Ϊ����Ľ������84����Һ���ʹ�����ж���Cl��+ ClO��+2H+= Cl2��+ H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ѡ����ȡ������ˮ�еĵ���ȡ����������ȡ��Ӧ�߱��������ǡ�( )
A��������ˮ���ұ�������ⷢ����ѧ��Ӧ B��������ˮ���ұ�ˮ������ʹ���ܽ�
C��������ˮ���ұ����ˮ�ܶȴ� D��������ˮ���ұ����ˮ�ܶ�С
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com