
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 2.3 | 4.0 | 开始溶解:7.8 |
| 完全沉淀时的pH | 3.7 | 5.2 | 完全溶解:10.8 |
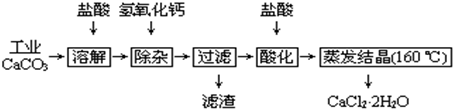


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
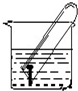 电化学在工业生产中有广泛应用.如图所示,水槽中试管内有一枚铁钉,放置数天观察,发现铁钉被腐蚀.
电化学在工业生产中有广泛应用.如图所示,水槽中试管内有一枚铁钉,放置数天观察,发现铁钉被腐蚀.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaCl2 |
| B、Ba(NO3)2 |
| C、Ba(OH)2 |
| D、AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、易溶于水的固体物质与水用蒸馏的方法分离 |
| B、互溶的液体用蒸馏的方法分离 |
| C、互不相容的两种液体用分液的方法分离 |
| D、难溶于水的物质与水用过滤的方法分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、化学反应:以石墨作电极电解氯化钠溶液,离子方程式:2Cl-+2H2O
| ||||
| B、化学反应:以银作电极电解硝酸银溶液,离子方程式4Ag++2H2O=4Ag+O2↑+4H+ | ||||
| C、化学反应:铅蓄电池正极反应,离子方程式:PbO2+4H++2e-═Pb2++2H2O | ||||
| D、化学反应:氢氧燃料电池(KOH做电解液)负极反应,离子方程式:O2+4e-+2H2O=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 熔点 | 沸点 | 密度 | 溶解性 |
| 甲 | -11.5℃ | 198℃ | 1.11 g?mL-1 | A、B互溶且均易溶于水 |
| 乙 | -17.9℃ | 290℃ | 1.26 g?mL-1 |
| A、萃取法 | B、蒸馏法 |
| C、分液法 | D、结晶法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
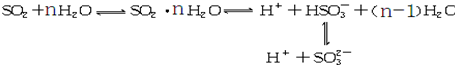
| A、该溶液中所含微粒种类至少6种 |
| B、向该溶液中加入少量BaCl2固体,上述平衡向正向移动 |
| C、向该溶液中加入足量的酸都能放出SO2气体 |
| D、该溶液中:C(H+)>C(HSO3-)>C(SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝作还原剂,氢气做氧化产物 |
| B、该反应属于典型的放热反应 |
| C、如果把该反应设计成原电池,铁、锌均可以做正极 |
| D、标况下,转移2mol 电子,就生成22.4L的氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com