
【题目】在反应:11P+15CuSO4+24H2O==5Cu3P+6H3PO4+15H2SO4中,7.5 mol CuSO4可氧化磷原子的物质的量为( )
A.1.5 mol B.3 mol C.5 mol D.6 mol
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知某饱和溶液中:①溶液的质量;②溶剂的质量;③溶液的体积;④溶质的摩尔质量;⑤溶质的溶解度;⑥溶液的密度,从上述条件中不能用来计算该饱和溶液的物质的量浓度的是( )
A.④⑤⑥B.①②③④C.①②④⑥D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明化学反应有一定的限度,进行了如下探究活动:
步骤1:取8mL0.1![]() 的KI溶液于试管,滴加0.1
的KI溶液于试管,滴加0.1![]() 的FeCl3溶液5~6滴,振荡;
的FeCl3溶液5~6滴,振荡;
请写出步骤1中发生的离子反应方程式:_________________
步骤2:在上述试管中加入2mLCCl4,充分振荡、静置;
步骤3:取上述步骤2静置分层后的上层水溶液少量于试管,滴加0.1![]() 的KSCN溶液5~6滴,振荡,未见溶液呈血红色。
的KSCN溶液5~6滴,振荡,未见溶液呈血红色。
探究的目的是通过检验Fe3+,来验证是否有Fe3+残留,从而证明化学反应有一定的限度。针对实验现象,同学们提出了下列两种猜想:
猜想一:KI溶液过量,Fe3+完全转化为Fe2+,溶液无Fe3+
猜想二:Fe3+大部分转化为Fe2+,使生成Fe(SCN)3浓度极小,肉眼无法观察其颜色为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚比水轻且微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大。
信息二:Fe3+可与![]() 反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。
反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。
结合新信息,请你完成以下实验:各取少许步骤2静置分层后的上层水溶液于试管A、B中,请将相关的实验操作、预期现象和结论填入下表空白处:
实验操作 | 预期现象 | 结论 |
实验1:在试管A加入少量乙醚,充分振荡,静置 | _________________ | ________________ |
实验2:__________________________ __________________________________ | 若产生蓝色沉淀 | 则“猜想二”成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A.硫酸型酸雨的形成会涉及反应:![]()
B.用苛性钠溶液吸收过量SO2:![]()
C.足量氯水和碘化亚铁溶液的反应:![]()
D.工业上氯气和石灰乳反应制漂白粉:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业烟气中含有CO、N2、SO2等气体,用Na2SO3溶液吸收并回收SO2的过程如图所示。
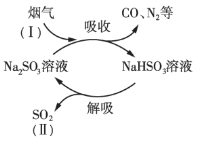
(1)SO2的浓度:Ⅰ______Ⅱ(填“>”或“<”)。
(2)图示过程中可以循环利用的物质是______(填化学式)。
(3)上述吸收过程中发生的主要反应的化学方程式是______。
(4)解吸过程需要加热,在这个过程中常伴有少量SO42-产生。
①证明产物中含SO42-的实验方法是:取少量解吸后的溶液,______(填操作和现象)。
②产生SO42-的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
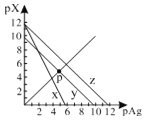
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 溶液焰色反应时,如果火焰呈黄色就说明该溶液一定有钠元素,一定没有钾元素
B. 除去CO2中的HCl气体,只需将气体通过NaOH溶液
C. 在某溶液中滴加硝酸酸化的氯化钡溶液,有白色沉淀生成,说明溶液中一定含SO![]()
D. 在氧化还原反应中,阳离子也能失去电子被氧化,阴离子也能得到电子被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
(1)硫元素是一种常见的非金属元素,硫原子的原子结构示意图为_______,自然界中存在的某种单质以八个原子结合,其分子式为_______,在我国古代,硫单质常被用于制作黑火药,爆炸时往往会产生一种刺激性气味的气体,这种气体产生的原因是(化学方程式)_______________________。硫单质还能够与金属元素反应,试写出硫单质与金属铜的反应方程式为______________________,产物中阴离子的电子式为_________。
(2)浓硫酸是一种重要的化工原料,具有____性、_____性、____性,请写出铜与浓硫酸反应的方程式_________________,此外浓硫酸也能够与某些非金属元素单质反应,试写出焦炭与浓硫酸反应的化学方程式__________________。
(3)氮元素是大气中含量最高的元素,其单质的电子式___________。由于该单质比较稳定,只能与部分活泼金属反应,比如在点燃条件下,可与金属镁反应,试写出该反应方程式___________________________。工业固氮的化学方程式为:________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com