
【题目】某同学采用硫铁矿焙烧取取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如图流程:
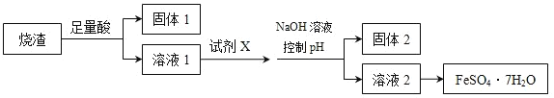
下列说法不正确的是( )
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D.若在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离可得到FeSO4·7H2O
【答案】D
【解析】
硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其它杂质),混合物中加入足量硫酸,Fe2O3、Al2O3与酸反应生成的硫酸铁、硫酸铝,二氧化硅不反应,过滤,固体1为二氧化硅;在滤液中加入铁粉将铁离子还原为亚铁离子,调节pH值使铝离子完全生成氢氧化铝沉淀,过滤,固体2为氢氧化铝,溶液2为硫酸亚铁,蒸发浓缩、冷却结晶、过滤,得到硫酸亚铁晶体,以此进行解答。
A.由流程分析可知,溶解烧渣选用足量硫酸,X为铁粉,故A正确;
B.由流程分析可知,固体1中一定含有SiO2,调节pH值使铝离子完全生成氢氧化铝沉淀,则固体2为氢氧化铝,故B正确;
C.亚铁离子易被空气中的氧气氧化,而且受热易失去结晶水,所以从溶液2得到FeSO47H2O产品的过程中,须控制条件防止其氧化和分解,故C正确;
D.在溶液1中含有铁离子和铝离子,加过量的氢氧化钠,铝离子转化为偏铝酸根离子,铁离子与氢氧根离子结合生成氢氧化铁沉淀,所以最终得到的是硫酸铁而不是硫酸亚铁,故D错误;
答案选D。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列有关叙述正确的是( )
A.2.24LCO2与足量Na2O2反应,转移的电子数目为0.1NA
B.1molCH4与足量的C12在光照下反应生成的CH3C1分子数为NA
C.已知反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-akJ/mol,当生成NA个SO3分子时,反应放出的热量小于0.5akJ
2SO3(g) ΔH=-akJ/mol,当生成NA个SO3分子时,反应放出的热量小于0.5akJ
D.在1L0.1mol/L碳酸钠溶液中,阴离子总数大于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料在国民经济建设等领域具有重要应用,镁、铬、镍、铜是几种重要的金属元素。请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为__,结构中有__种不同形状的电子云。
(2)镁属于元素周期表中的__区元素,MgO的熔点高于CuO的原因是__。
(3)氯化铬酰(CrO2Cl2)熔点:-96.5℃,沸点:117℃,能与CS2等互溶,则固态CrO2Cl2属于__晶体。已知NO2+与CS2互为等电子体,则1molNO2+中含有π键数目为__。
(4)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为__,[Cu(CH3C≡N)4]+中所有元素的电负性由大到小的顺序是__,BF4-的空间构型为__。
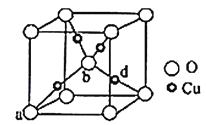
(5)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(![]() ,
,![]() ,
,![]() ),则d的坐标参数为__,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数(晶胞棱长)为__cm(列出计算式即可)。
),则d的坐标参数为__,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数(晶胞棱长)为__cm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是( )
3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.4mol/(L·s)
B.v(B)=0.3mol/(L·s)
C.v(C)=0.3mol/(L·s)
D.v(D)=2mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁粉和铝粉的混合物与足量很稀的硝酸充分反应,无气体放出。在反应结束后的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(ml)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法不正确的是( )
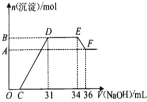
A.溶液中n(NH4+)=0.012mol
B.混合物中铝粉与铁粉物质的量的比为1:2
C.测定F点沉淀的质量,步骤是:过滤、洗涤、低温烘干、称量
D.铝与该浓度硝酸反应的离子方程式为:8Al+30H++3NO3-=8Al3++3NH4++9H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A.浸泡在冷水中的NO2球颜色变浅
B.合成氨工业中不断从反应混合物中液化分离出氨气
C.实验室中常用排饱和食盐水的方法收集Cl2
D.使用催化剂使合成氨速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种常见的有机物,其中A的产量通常用来衡量一个国家的石油化工发展水平,B与C在浓硫酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略):
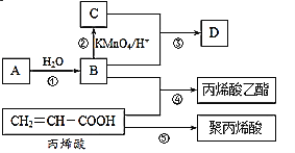
(1)C中官能团的名称为___,③的化学方程式为__。
(2)丙烯酸(CH2=CH-COOH)的性质可能有___。(多选)
A.加成反应 B.取代反应 C.中和反应 D.氧化反应
(3)用一种方法鉴别B和C,所用试剂是__。
(4)丙烯酸乙酯的结构简式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。下列说法正确的是
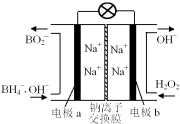
A.电池放电时Na+从b极区移向a极区
B.该电池的负极反应为:BH4-+8OH--8e-===BO2-+6H2O
C.电极a采用MnO2,MnO2既作电极材料又有催化作用
D.每消耗3 mol H2O2,转移的电子为3 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com