
【题目】含Ti化合物在工业生产中有着重要用途。TiCl3是烯烃定向聚合的催化剂、TiCl4可用于制备金属Ti。
nCH3CH=CH2 ![]()
![]()
TiCl4+2Mg![]() Ti+2MgCl2
Ti+2MgCl2
TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
(1)Ti3+的基态核外电子排布式为__________;
(2)丙烯分子中,碳原子轨道杂化类型为__________;
(3)Mg、Al、Cl第一电离能由大到小的顺序是___________;
(4)写出一种由第2周期元素组成且与CO互为等电子体的阴离子的电子式____;
(5)TiCl3浓溶液中加入无水乙醚,并通入HCl至饱和,在乙醚层得到绿色的异构体,分别是[Ti(H2O)6]Cl3、[Ti(H2O)5Cl]Cl2·H2O。1mol[Ti(H2O)6]Cl3中含有σ键的数目为______;
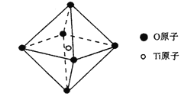
(6)钛酸锶具有超导性、热敏性等优点,该晶体的晶胞中Sr位于晶胞的顶点,O位于晶胞的面心,Ti原子填充在O原子构成的正八面体空隙的中心位置(如图),据此推测,钛酸锶的化学式为_________。
【答案】[Ar]3d1 sp2、sp3 Cl>Mg>Al ![]() 或
或![]() 18 mol SrTiO3
18 mol SrTiO3
【解析】
本题主要考查物质的结构与晶胞计算。
(1)Ti是22号元素,其原子核外有22个电子,Ti元素失去4s能级上2个电子、3d能级上电子生成![]() ,根据构造原理书写
,根据构造原理书写![]() 的基态核外电子排布式。
的基态核外电子排布式。
(2)丙烯中存在C=C-C,双键C中σ键为3,单键C的σ键为4,均不含孤对电子。
(3)同周期随原子序数增大,第一电离能呈增大趋势,元素原子各轨道为半满、全满、全空时,能量较低,第一电离能高于同周期相邻元素的。
(4)价电子数相等、原子个数相等的微粒为等电子体。
(5)在配合物[Ti(H2O)6]Cl3中,6个水分子与钛离子之间有6个配位键,为σ键,每个水分子内有2个单键,也是σ键,所以每个配合物中的配位键数为![]() 。
。
(6)该晶体的晶胞中Sr位于晶胞的顶点,则该晶胞中Sr原子个数=![]() ,O位于晶胞的面心,则O原子个数=
,O位于晶胞的面心,则O原子个数=![]() ,Ti原子填充在O原子构成的正八面体空隙的中心位置,个数为1,据此推测钛酸锶的化学式。
,Ti原子填充在O原子构成的正八面体空隙的中心位置,个数为1,据此推测钛酸锶的化学式。
(1)Ti是22号元素,其原子核外有22个电子,Ti元素失去4s能级上2个电子、3d能级上电子生成Ti3+,根据构造原理书写Ti3+的基态核外电子排布式为![]() 。
。
故答案为:![]() ;
;
(2)丙烯中存在C=CC,双键C中σ键为3,单键C的σ键为4,均不含孤对电子,杂化类型分别为![]() 、
、![]() 。
。
故答案为:![]() 、
、![]() ;
;
(3)同周期随原子序数增大,第一电离能呈增大趋势,元素原子各轨道为半满、全满、全空时,能量较低,第一电离能高于同周期相邻元素的,所以第一电离能Cl>Mg>Al。
故答案为:Cl>Mg>Al。
(4)由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式为,![]() 。
。
故答案为:![]() ;
;
(5)在配合物[Ti(H2O)6]Cl3中,6个水分子与钛离子之间有6个配位键,为σ键,每个水分子内有2个单键,也是σ键,所以每个配合物中的配位键数为![]() ,所以1mol配合物中含σ键的数目为18mol。
,所以1mol配合物中含σ键的数目为18mol。
故答案为:18mol;
(6)该晶体的晶胞中Sr位于晶胞的顶点,则该晶胞中Sr原子个数=![]() ,O位于晶胞的面心,则O原子个数=
,O位于晶胞的面心,则O原子个数=![]() ,Ti原子填充在O原子构成的正八面体空隙的中心位置,个数为1,则Sr、O、Ti原子个数为1:3:1,据此推测钛酸锶的化学式SrTiO3。
,Ti原子填充在O原子构成的正八面体空隙的中心位置,个数为1,则Sr、O、Ti原子个数为1:3:1,据此推测钛酸锶的化学式SrTiO3。
故答案为:SrTiO3。


 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验装置(夹持和尾气处理装置已省略)进行的相应实验,不能达到实验目的的是
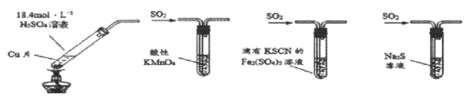
A.若将甲中上层清液倒入水中,观察到溶液呈蓝色,说明有CuSO4生成
B.图乙装置中溶液的颜色变浅,说明SO2具有漂白性
C.图丙装置中溶液的颜色变浅,说明SO2具有还原性
D.图丁装置中产生淡黄色沉淀,说明SO2或H2SO3具有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下(T2> Tl),在3个体积均为2.0 L的恒容密闭容器中反应 2NO(g)+ Cl2(g) = 2ClNO(g)(正反应放热)达到平衡,下列说法正确的是

A. 达到平衡时,容器I与容器II中的总压强之比为1:2
B. 达到平衡时,容器III中ClNO的转化率小于80%
C. 达到平衡时,容器II中c(ClNO(/ c(NO)比容器I中的大
D. 若温度为Tl,起始时向同体积恒容密闭容器中充入0.20 mol NO(g)、0.2 mol Cl2(g)和0.20 mol ClNO(g),则该反应向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气中含有SO2,易形成酸雨、污染大气。有效去除和利用SO2是环境保护的重要议题。
(1)双碱法洗除SO2。NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
①上述过程生成Na2SO3的离子方程式为_________。
②双碱法洗除SO2的优点为_________。
(2)NaClO2氧化法吸收SO2。向NaClO2溶液中通入含有SO2的烟气,反应温度为323 K,反应一段时间。
①随着吸收反应的进行,吸收剂溶液的pH逐渐_________(填“增大”“不变”或“减小”)。
②如果采用NaClO替代NaClO2,也能得到较好的烟气脱硫效果。吸收等量的SO2,所需NaClO的物质的量是NaClO2的_________倍。
(3)SO2的利用。生产焦亚硫酸钠(Na2S2O5),通常是由NaHSO3过饱和溶液经结晶脱水制得。利用烟道气中的SO2生产Na2S2O5的工艺如下:
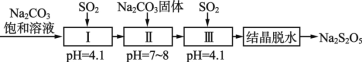
①Ⅰ中反应的化学方程式为___________。
②若Ⅲ中通入SO2不足,结晶脱水得到的Na2S2O5中混有的主要杂质是_______(填化学式)。
③工艺中加入Na2CO3固体,并再次充入SO2的目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟基香茅醛是一种日化香料,主要用于配制柑桔、西瓜、樱桃等瓜果型香精,其结构简式如图所示。请回答下列问题:
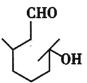
(1)羟基香茅醛的分子式为___,按系统命名法写出其名称:___,其中含有的官能团有___。
(2)观察羟基香茅醛的结构简式,请判断该有机化合物不能发生的反应是___(填序号)。
A.酯化反应 B.加成反应 C.消去反应 D.水解反应 E.银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 Na2FeO4是一种离效多功能水处理剂。一种制备Na2FeO4的方法可用化学方程式表示如下:2Fe + 6Na2O2 = 2Na2FeO4 + 2 ![]() + O2↑。下列对此反应的说法中,不正确的是
+ O2↑。下列对此反应的说法中,不正确的是
A.方框中的物质为Na2SO4
B.Na2O2既是氧化剂,又是还原剂
C.Na2FeO4既是氧化产物,又是还原产物
D.2molFeSO4发生反应时,反应中共转移8mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒石酸托特罗定主要用于治疗泌尿系统疾病。工业合成该药物的中间体(F)的路线如下:
回答下列问题:
(1)D分子中的含氧官能团名称为 __________;B→C包含两步反应,反应类型分别为_______、_______;
(2)A的结构简式为________;
(3)写出苯甲醛与银氨溶液反应的化学方程式 _______;
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:_____________;
①能使溴的CCl4溶液褪色;②能与FeCl3溶液发生显色反应;③苯环上的一氯代物有一种;④分子中有4种不同化学环境的氢。
(5)已知呋喃丙胺(![]() CH=CHCON(CH3)2 )是一种高效麻醉剂,写出以
CH=CHCON(CH3)2 )是一种高效麻醉剂,写出以![]() 、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_________________。
、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A. 向四羟基合铝酸钠溶液中滴加过量的碳酸氢钠溶液:[Al(OH)4]—+4H+=Al3++2H2O
B. 将少量SO2气体通入足量的NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO
C. NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH—=BaSO4↓+2H2O
D. 向沸水中滴加饱和氯化铁溶液:Fe3++3H2O=Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
热化学方程式 | 平衡常数 | |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
则该温度下,ΔH3=_______________kJmol-1;K3=_____________(用K1和K2表示)。
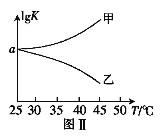
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则ΔH3 ___(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是_____________;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是______(填“甲”或“乙”),a值为__________。25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,则此时v正_________v逆(填“>”“<”或“=”)

(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com