
【题目】某硫酸盐在工农业生产上有广泛用途。它的组成可表达为KxFey(SO4)z·nH2O(其中Fe为+2价)。为测定它的组成可通过下列实验:
步骤Ⅰ:称取22.80 g样品,配制成100.00 mL溶液A。
步骤Ⅱ:量取25.00 mL溶液A,用0.300 0 mol·L-1酸性KMnO4溶液滴定至终点(滴定过程中MnO4-与Fe2+反应生成Mn2+和Fe3+),消耗KMnO4溶液10.00 mL。
步骤Ⅲ:量取25.00 mL溶液A,加入足量的四苯硼酸钠{Na[B(C6H5)4]}溶液至沉淀完全,得白色固体四苯硼酸钾(摩尔质量为358 g·mol-1)10.74 g。该反应的离子方程式为K++[B(C6H5)4]-=K[B(C6H5)4]↓。
(1)判断步骤Ⅱ滴定终点的现象是________,写出步骤Ⅱ中的离子反应方程式:________。
(2)已知常温下K[B(C6H5)4]的Ksp=2.0×10-13,欲使溶液中c(K+)≤1.0×10-5 mol·L-1,此时溶液中c{[B(C6H5)4]-}≥________mol·L-1。
(3)通过计算确定样品的化学式__________(写出计算过程)。
【答案】溶液由无色变为(浅)红色且半分钟不变色 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 2.0×10-8 溶液中n(K+)=![]() ×4=0.12mol,n(Fe2+)=0.300 0 mol·L-1×0.01L×5×4=0.06mol,根据电荷守恒可知n(K+)+2n(Fe2+)=2n(SO42-)可得n(SO42-)=
×4=0.12mol,n(Fe2+)=0.300 0 mol·L-1×0.01L×5×4=0.06mol,根据电荷守恒可知n(K+)+2n(Fe2+)=2n(SO42-)可得n(SO42-)=![]() =
=![]() =0.12mol,根据样品的质量可计算出结晶水的物质的量n(H2O)=
=0.12mol,根据样品的质量可计算出结晶水的物质的量n(H2O)=![]() =0.18mol,因此n(K+):n(Fe2+):n(SO42-):n(H2O)=0.12:0.06:0.12:0.18=2:1:2:3,所以化学式为K2Fe (SO4)2·3H2O
=0.18mol,因此n(K+):n(Fe2+):n(SO42-):n(H2O)=0.12:0.06:0.12:0.18=2:1:2:3,所以化学式为K2Fe (SO4)2·3H2O
【解析】
(1)量取25.00 mL溶液A,用0.300 0 mol·L-1酸性KMnO4溶液滴定至终点,其中高锰酸钾溶液可做指示剂,自身为紫色,达到滴定终点时,因发生了氧化还原反应而使其颜色发生了变化;滴定过程中MnO4-与Fe2+反应生成Mn2+和Fe3+,发生了氧化还原反应,根据氧化还原反应的规律书写离子方程式;
(2)根据Ksp{K[B(C6H5)4]}= c(K+) c{[B(C6H5)4]-}进行计算;
(3)量取25.00 mL溶液A,加入足量的四苯硼酸钠{Na[B(C6H5)4]}溶液至沉淀完全,得白色固体四苯硼酸钾(摩尔质量为358 g·mol-1)10.74 g,可知100.00 mL溶液中含K+的物质的量n(K+)=![]() ×4=0.12mol;量取25.00 mL溶液A,用0.300 0 mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液10.00 mL,可知100.00 mL溶液中n(Fe2+)=0.300 0 mol·L-1×0.01L×5×4=0.06mol,根据电荷守恒可计算出溶液中SO42-的物质的量,再根据样品的质量计算出结晶水的质量,最终可确定各离子和水的物质的量之比,进而确定化学式。
×4=0.12mol;量取25.00 mL溶液A,用0.300 0 mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液10.00 mL,可知100.00 mL溶液中n(Fe2+)=0.300 0 mol·L-1×0.01L×5×4=0.06mol,根据电荷守恒可计算出溶液中SO42-的物质的量,再根据样品的质量计算出结晶水的质量,最终可确定各离子和水的物质的量之比,进而确定化学式。
(1)量取25.00 mL溶液A,用0.300 0 mol·L-1酸性KMnO4溶液滴定至终点,其中高锰酸钾溶液可做指示剂,自身为紫色,达到滴定终点时,溶液由无色变为(浅)红色且半分钟不变色;滴定过程中MnO4-与Fe2+反应生成Mn2+和Fe3+,发生了氧化还原反应,离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(2)因Ksp{K[B(C6H5)4]}= c(K+) c{[B(C6H5)4]-},那么c{[B(C6H5)4]-}=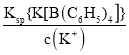 =
=![]() =2.0×10-8 mol·L-1,因此当溶液中c(K+)≤1.0×10-5 mol·L-1时,溶液中c{[B(C6H5)4]-}≥2.0×10-8mol·L-1。
=2.0×10-8 mol·L-1,因此当溶液中c(K+)≤1.0×10-5 mol·L-1时,溶液中c{[B(C6H5)4]-}≥2.0×10-8mol·L-1。
(3)量取25.00 mL溶液A,加入足量的四苯硼酸钠{Na[B(C6H5)4]}溶液至沉淀完全,得白色固体四苯硼酸钾(摩尔质量为358 g·mol-1)10.74 g,可知100.00 mL溶液中含K+的物质的量n(K+)=![]() ×4=0.12mol;量取25.00 mL溶液A,用0.300 0 mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液10.00 mL,可知100.00 mL溶液中n(Fe2+)=0.300 0 mol·L-1×0.01L×5×4=0.06mol,根据电荷守恒可知n(K+)+2n(Fe2+)=2n(SO42-),那么n(SO42-)=
×4=0.12mol;量取25.00 mL溶液A,用0.300 0 mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液10.00 mL,可知100.00 mL溶液中n(Fe2+)=0.300 0 mol·L-1×0.01L×5×4=0.06mol,根据电荷守恒可知n(K+)+2n(Fe2+)=2n(SO42-),那么n(SO42-)=![]() =
=![]() =0.12mol,进一步可知n(H2O)=
=0.12mol,进一步可知n(H2O)=![]() =0.18mol,因此n(K+):n(Fe2+):n(SO42-):n(H2O)=0.12:0.06:0.12:0.18=2:1:2:3,所以化学式为K2Fe (SO4)2·3H2O。
=0.18mol,因此n(K+):n(Fe2+):n(SO42-):n(H2O)=0.12:0.06:0.12:0.18=2:1:2:3,所以化学式为K2Fe (SO4)2·3H2O。


科目:高中化学 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性。
I.实验室制备FeBr2实验室用如图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时,先将铁粉加热至600—700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始。不断将d中液溴滴入温度为100—120℃的D中。经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁。

(1)若在A中盛固体CaCO3,a中盛6 mol/L盐酸。为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为_____________。C为________________。为防止污染空气,实验时应在F处连接盛___________的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用是____________________。
Ⅱ.探究FeBr2的还原性
(3)实验需要200 mL 0.1 mol/L FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外,还需要的玻璃仪器是_____________,需称量FeBr2的质量为:_________。
(4)取10 mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br一被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+
设计实验证明假设2是正确的:________
(5)请用一个离子方程式来证明还原性Fe2+>Br一________:
(6)若在40 mL上述FeBr2溶液中通入3×10-3mol Cl2,则反应的离子方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)NH4Al(SO4)2可作净水剂,其理由是__________________(用必要的化学用语和相关文字说明).
(2)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同)。
A.c(H+) B.![]()
C.c(H+)·c(OH-) D.![]()
E.![]()
若该溶液升高温度,上述5种表达式的数据一定增大的是___________。
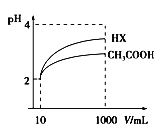
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1 000mL,稀释过程pH变化如图:则HX的电离平衡常数_____________(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是____________________;稀释后,HX溶液中由水电离出来的c(H+)___________(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+)。
(4)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的![]() =____________。
=____________。
(5)①25℃时,Ka(HCN)=4.9×l0-10,Ka(CH3COOH)=1.8×l0-5,H2CO3:K1=4.3×l0-7、K2=5.6×l0-11,25℃时有pH相等的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三溶液的物质的量浓度由大到小的顺序为_____________.
②向NaCN溶液中通入少量CO2,所发生反应的化学方程式为:_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用pH=m的盐酸滴定20mL pH=n的MOH溶液,且m+n=14。混合溶液的pH与盐酸体积V的关系如图所示。下列说法正确的是( )
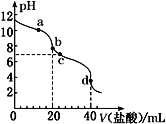
A.a点:c(Cl-)>c(M+)>c(OH-)>c(H+)
B.b点:MOH和HCl恰好完全反应
C.c点:c(H+)=c(OH-)+c(MOH)
D.a点到d点:水电离的c(H+)·c(OH-)先变大,后变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现半胱氨酸能增强艾滋病毒感染者的免疫力,对控制艾滋病毒的蔓延有奇效。已知半胱氨酸的结构简式为 ,下列关于半胱氨酸说法不正确的是
,下列关于半胱氨酸说法不正确的是
A. 能溶于水、乙醇等溶剂
B. 既能与盐酸、又能与NaOH溶液反应
C. 与 (高半胱氨酸)互为同系物
(高半胱氨酸)互为同系物
D. 官能团不变的同分异构体有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个电化学过程的示意图,请回答下列问题:

(1)图中甲池是_________ (填“原电池” “电解池”或“电镀池”)。
(2)A(石墨)电极的名称是_________ (填“正极” “负极” “阴极”或“阳极”)
(3)写出通入CH3OH的电极的电极反应式________________
(4)乙池中反应的化学方程式为__________________。当乙池中B(Ag)极质量增加54g,甲池中理论上消耗O2的体积为____L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.用铝粉和NaOH溶液反应制取少量H2 Al+2OH-=AlO2-+H2↑
B.电解饱和食盐水制备Cl2 2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C.向氢氧化钡溶液中加入稀硫酸 Ba2++OH-+H++ SO42-=BaSO4↓+H2O
D.向碳酸氢铵溶液中加入足量石灰水 Ca2++HCO3-+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在密闭容器反应,达到平衡状态的标志是()
2NO+O2在密闭容器反应,达到平衡状态的标志是()
(1)单位时间内生成n mol O2的同时生成2n mol NO2
(2)单位时间内生成n mol O2的同时生成2n mol NO
(3)用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态.
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1mol/L①CH3COOH、②NaOH、③CH3COONa,下列叙述正确的是( )
A.①中[CH3COOH]>[CH3COO-]>[H+]>[OH-]
B.①②等体积混合后,醋酸根离子浓度小于③的二分之一
C.①③等体积混合以后,溶液呈酸性,则(Na+)>(CH3COO-)>(H+)
D.①②等体积混合以后,水的电离程度比①③等体积混合的电离程度小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com