
【题目】下图是实验室制备气体和验证气体性质的装置图,若利用该装置实现碳和浓硫酸的反应,并进行如下验证:

(1)实验步骤: 连接仪器、_________________、加药品后,然后滴入浓硫酸,加热。
(2)C与浓硫酸反应的化学方程式是___________________________。
(3)若要证明产物中的两种气体,装置B、C、D、E中分别装有品红溶液、酸性KMnO4溶液、品红溶液、澄清石灰水,则B、D装置中品红溶液的作用分别是________________,_________________。证明气体中有CO2的现象是____________________________。
(4)将A产生的气体通入下图装置(忽略氧气对反应的影响)进行如下探究实验。
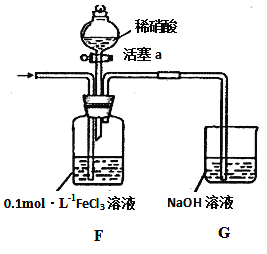
实验记录如下:
实验序号 | 实验操作 | 实验现象 |
I | 向F装置中通入一段时间的气体. | F中溶液色溶液最终变为浅绿色 |
II | 取出少量F装置中的溶液,先加入 KSCN溶液,再加入BaCl2溶液 | 加入KSCN溶液后溶液不变色;再加入BaCl2溶液产生白色沉淀. |
III | 打开活塞a,将过量稀HNO3加入装置F中,关闭活塞a | F中浅绿色溶液最终变为黄色. |
IV | 取出少量A装置中的溶液,加入KSCN溶液 | 溶液变为红色. |
实验II中发生反应的离子方程式是_____________________;实验III中,浅绿色溶液变为黄色的原因是___________________________________________ (用语言叙述);综合上述实验得岀的结论是:在酸性条件下,NO3﹣、Fe3+氧化性强弱顺序为_____________________
【答案】 检查装置气密性 C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O 验证SO2的存在 检验SO2是否除尽 D中品红不褪色,E中澄清石灰水变浑浊 Ba2++SO42﹣=BaSO4↓ 酸性条件下,NO3﹣把Fe2+氧化为Fe3+ NO3﹣>Fe3+
CO2↑+2SO2↑+2H2O 验证SO2的存在 检验SO2是否除尽 D中品红不褪色,E中澄清石灰水变浑浊 Ba2++SO42﹣=BaSO4↓ 酸性条件下,NO3﹣把Fe2+氧化为Fe3+ NO3﹣>Fe3+
【解析】试题分析:(1)实验室制备气体,连接仪器后要检验装置气密性。(2)C与浓硫酸反应生成二氧化碳、二氧化硫、水。
(3)若要证明产物中的两种气体, B装置中品红检验二氧化硫、C装置中酸性KMnO4溶液除去二氧化硫、D装置中品红检验二氧化硫是否除尽E装置中澄清石灰水检验二氧化碳。
(4)加入KSCN溶液后溶液不变色说明实验I中铁离子被还原为Fe2+,二氧化硫被氧化为SO42﹣,再加入BaCl2溶液产生硫酸钡沉淀;滴入硝酸,F中浅绿色溶液最终变为黄色,说明NO3﹣把Fe2+氧化为Fe3+;根据氧化还原反应规律判断NO3﹣、Fe3+氧化性强弱。
解析:(1)实验室制备气体,连接仪器后要检验装置气密性。
(2)C与浓硫酸反应生成二氧化碳、二氧化硫、水,反应方程式为C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
(3)B装置中品红检验二氧化硫、C装置中酸性KMnO4溶液除去二氧化硫、D装置中品红检验二氧化硫是否除尽E装置中澄清石灰水检验二氧化碳。证明气体中有CO2的现象是D中品红不褪色,E中澄清石灰水变浑浊。
(4)加入KSCN溶液后溶液不变色说明实验I中铁离子被还原为Fe2+,二氧化硫被氧化为SO42﹣,再加入BaCl2溶液产生硫酸钡沉淀,反应离子方程式为Ba2++SO42﹣=BaSO4↓;滴入硝酸,F中浅绿色溶液最终变为黄色,说明NO3﹣把Fe2+氧化为Fe3+;氧化剂的氧化性大于氧化产物的氧化性,所以氧化性NO3﹣>Fe3+。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】“关爱生命,注意安全”。惨痛的天津爆炸触目惊心,火灾之后依然火势绵延不绝的原因之一是易燃物中含有电石。工业上常用电石(主要成分为CaC2,杂质为CaS等)与水反应生产乙炔气。
(1)工业上合成CaC2主要采用氧热法。
已知:CaO(s)+3C(s)=CaC2(s)+CO(g) △H=+464.1kJ·mol-1
C(s)+l/2O2(g)=CO(g) △H=-110.5kJ.mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO,为维持热平衡,每生产l molCaC2,转移电子的物质的量为_______。
(2)已知2000℃时,合成碳化钙的过程中还可能涉及到如下反应
CaO(s)+C(s) ![]() Ca(g)+CO(g) K1 △H1=a KJ·mol-1
Ca(g)+CO(g) K1 △H1=a KJ·mol-1
Ca(g)+2C(s) ![]() CaC2(s) K2 △H2=b KJ·mol-1
CaC2(s) K2 △H2=b KJ·mol-1
2CaO(s)+CaC2(s) ![]() 3Ca(g)+2CO(g) K3 △H3=c KJ·mol-1
3Ca(g)+2CO(g) K3 △H3=c KJ·mol-1
则K1=_______ (用含K2、K3的代数式表示);c=_____(用含a、b的代数式表示)。
(3)利用电石产生乙炔气的过程中产生的H2S气体制取H2,既廉价又环保。
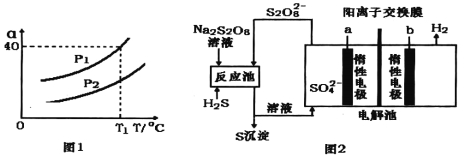
①利用硫化氢的热不稳定性制取氢气。在体积为2L的恒容密闭容器中,H2S起始物质的量为2mol,达到平衡后H2S的转化率![]() 随温度和压强变化如图l所示。据图计算T1℃时压强P1时,硫为气态,则平衡体系中H2的体积分数_____。由图知压强P1__P2(填“大于”“小于”或“等于”),理由是______。
随温度和压强变化如图l所示。据图计算T1℃时压强P1时,硫为气态,则平衡体系中H2的体积分数_____。由图知压强P1__P2(填“大于”“小于”或“等于”),理由是______。
②电化学法制取氢气的原理如图2,请写出反应池中发生反应的离子方程式_____,惰性电极a上发生的电极反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20 mL浓度为0.05 mol/L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol/L的NaXO4溶液完全反应。溶液中XO4-被还原为较低价态,则X元素的化合价变为
A. +1 B. +2 C. +3 D. +4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 以非极性键结合起来的双原子分子一定是非极性分子
B. 以极性键结合起来的分子一定是极性分子
C. 非极性分子只能是双原子单质分子
D. 金属银晶体为面心立方最密堆积,其配位数为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于1 mol/L的NaOH溶液,下列有关说法正确的是(NA表示阿伏加德罗常数)
A. Na+的数目为NA B. OH-的物质的量为1mol
C. Na+的物质的量浓度为1mol/L D. NaOH的质量为40g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.18O原子核内的中子数为8
B.16O2和18O2的化学性质几乎相同
C.H216O与H218O质子数不同
D.H2和D2属于同位素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com