
【题目】如图装置就用于实验室制取NH3 , 并用AlCl3溶液吸收多余氨气制氢氧化铝,最后回收氯化铵的实验,能达到实验目的是( )
A.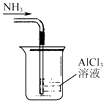
吸收NH3制取Al(OH)3
B.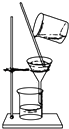
在不断搅拌下分离Al(OH)3和NH4Cl溶液
C.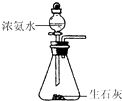
制取NH3
D.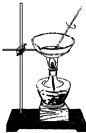
蒸干NH4Cl溶液并灼烧制NH4Cl
科目:高中化学 来源: 题型:
【题目】在如下图的实验装置中,实验开始一段时间后,对看到的现象叙述不正确的是 ( )

A.苹果块会干瘪 B.胆矾晶体表面有“白斑”
C.小试管内有KNO3晶体析出 D.pH试纸变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化物在工业生产、日常生活中应用都非常广泛.某学习小组为探究一些实用性很强的氯化物,进行了一系列的资料查询与具体实验.
(1)用于制造电池的原材料二氯亚砜(SOCl2),是一种液态化合物,沸点为77℃.在盛10mL水的锥形瓶中小心滴加8~10滴SOCl2可观察到剧烈反应,液面上形成白雾,并逸出刺激性气味的气体,该气体可使沾有品红试液的滤纸褪色.轻轻振荡锥形瓶,待白雾消失后往溶液中滴加AgNO3溶液,有不溶于稀HNO3的白色沉淀析出.室温下,小组某同学取2.38g SOCl2与水发生上述反应,测得放出热量为17.88kJ.根据以上实验,写出SOCl2与水反应的热化学方程式 .
(2)低温蒸干AlCl3溶液得到固体的主要成分是;小组某同学想制取无水AlCl3固体,他提出可以用AlCl36H2O与SOCl2混合后共热来制取无水AlCl3固体,你认为可行吗?请说明原因 .
(3)TiO2是一种非常好的催化剂.某同学通过查阅资料显示:TiCl4水解程度很大,可以用于TiO2的制备,制备时加入大量的水,同时加热,促进水解趋于完全,所得TiO2xH2O经焙烧得TiO2 . 请写出TiCl4水解的化学方程式
(4)某同学利用NaCl溶液设计实验验证Fe在原电池反应中的生成物,使用Cu电极、Fe电极、经过酸化的3%NaCl溶液,组成原电池装置,实验结束后,该同学往Fe电极区滴入2滴黄色铁氰化钾溶液,现象是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为证明稀硝酸与铜反应产物中气体为NO,设计如图实验(实验过程中活塞2为打开状态),下列说法中不正确的是( ) 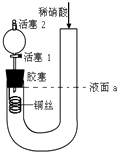
A.在装置左侧稍加热可以加快稀硝酸与铜的反应速率
B.关闭活塞1,加入稀硝酸至液面a处
C.通过关闭或开启活塞1可以控制反应的进行
D.反应开始后,胶塞下方有无色气体生成,还不能证明该气体为NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硫的说法不正确的是()
A.试管内壁附着的硫可用二硫化碳溶解除去
B.游离态的硫存在于火山喷口附近或地壳的岩层里
C.单质硫既有氧化性,又有还原性
D.硫在空气中的燃烧产物是二氧化硫,在纯氧气中的燃烧产物是三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片插入同浓度的稀硫酸中一段时间,下列叙述正确的是
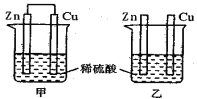
A. 甲中铜片是正极,乙中铜片是负极
B. 甲中铜被氧化,乙中锌被氧化
C. 产生气泡的速率甲比乙快
D. 两烧杯中铜片表面均无气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 16g CH4含有的原子数为NA
B. 17 g OH- 含有的质子数为9NA
C. 2g D2气体中含有的中子数为0.5 NA
D. 标准状况下22.4 L NH3含有的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要成分为Al2O3和SiO2,还含有少量的FeO、Fe2O3等)为原料制备Al2O3的流程如下:
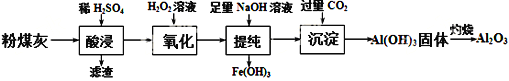
(1) “酸浸”时需加入过量的稀硫酸,写出Al2O3溶解的离子方程式___________________。
(2)证明酸浸后溶液中存在Fe3+的方法是:取酸浸后的溶液少许置于试管中,向其中滴加硫氰化钾溶液,溶液变为血红色;再慢慢滴入过量的H2O2溶液,溶液的红色先变深,之后红色逐渐褪去,继续滴加会有气泡逸出,该气体会使带火星的木条复燃。
①红色变深的原因是(用离子方程式表示):_____________________________;
②溶液红色褪去是由于过氧化氢氧化了硫氰根离子,已知双氧水氧化SCN—生成N2、CO2和SO42-,写出该反应的离子方程式:____________________________;
③有气体逸出,说明Fe3+对H2O2的分解有催化作用,写出催化过程第一步反应的离子方程式________________________________。

(3) “提纯”过程中,当加入NaOH溶液达到沉淀量最大时,溶液中c(SO42-)∶c(Na+)=___________。将H2S和空气的混合气体通入FeCl3 、FeCl2 、CuCl2的混合溶液中反应回收S,其物质转化如图所示。反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为______________。
(4) “沉淀”过程中,通入过量CO2时发生反应的化学方程式为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com