
����Ŀ��X��Y��Z��WΪԪ�����ڱ�ǰ�����ڵ�Ԫ�ء�����X���γɻ�������������Ԫ�أ�Y���ڲ��������������������9����Z��Ԫ�����ڱ��е縺������Ԫ�أ�WԪ�صĵ������Ӳ㴦��ȫ����״̬�ҵ��ĵ��Ӳ�ֻ��2�����ӡ���ش��������⡣
(1)WԪ����Ԫ�����ڱ��е�λ��Ϊ______________________________��
(2)W2�����백�������γ�������[W(NH3)4]2����д���������ӵĽṹ��ʽ(������λ��)_______��
(3)X�����⡢����������Ԫ�ع��ɻ�����XO(NH2)2������Xԭ�ӵ��ӻ���ʽΪ__________��1mol�÷����ЦҼ�����ĿΪ______________��������������ˮ����Ҫԭ����________________��
(4)X��ij�־���Ϊ��״�ṹ���������ڽ��������á���ԭ������ڸ���֮�䣬�γɼ�϶������䳣���ṹ��ƽ��ͶӰ��ͼ����ʾ�����仯ѧʽ�ɱ�ʾΪ______________________��
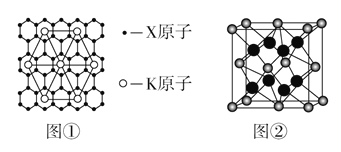
(5)Ԫ��Y��Ԫ��Z�γɵľ����ṹ��ͼ����ʾ���þ�����Y������Χ�����Z������Ϊ___����
���𰸡� ��4���ڢ�B�� �� sp2 7NA CO(NH2)2������ˮ����֮�����γ���� KC8 8
��������X��Y��Z��MΪԪ�����ڱ�ǰ�����ڵ�Ԫ�أ�Xԭ�Ӻ����L���������K�����������������X��2�����Ӳ㣬����������Ϊ4����XΪCԪ�أ�Y���ڲ��������������������9����Yֻ�ܴ��ڵ������ڣ�����������ֻ��Ϊ2���ڲ��������Ϊ18�������������Ϊ20����YΪCaԪ�أ�Z��Ԫ�����ڱ��ĸ�Ԫ���е縺�������ZΪFԪ�أ�WԪ�صĵ������Ӳ㴦��ȫ����״̬�ҵ��ĵ��Ӳ�ֻ��2�����ӣ���W��������Ϊ2+8+18+2=30����WΪZn��
(1)ZnԪ�غ˵����Ϊ30����Ԫ�����ڱ��е�λ��Ϊ��4���ڢ�B�壻
(2)[Zn(NH3)4]2+��Zn2+�пչ����N�й¶Ե��ӣ��������ӵĽṹ��ʽΪ ��
��
(3)XΪCԪ�أ���XO(NH2)2���ӵĽṹ��ʽΪ![]() �����Ը÷�����̼ԭ�ӵ��ӻ���ʽΪsp2�ӻ���ÿ�������к���7������������1mol�����к���7mol��������Ϊ
�����Ը÷�����̼ԭ�ӵ��ӻ���ʽΪsp2�ӻ���ÿ�������к���7������������1mol�����к���7mol��������Ϊ![]() ��ˮ���Ӽ����γ���������Ը���������ˮ��
��ˮ���Ӽ����γ���������Ը���������ˮ��
(4)����ȡ������ԭ���γɵ�С������Ϊ���㵥λ������ȫռ�е�̼ԭ������4��ռ�еļ�ԭ����Ϊ![]() ��3=
��3=![]() ����̼ԭ�����ͼ�ԭ����֮����4��
����̼ԭ�����ͼ�ԭ����֮����4��![]() =8��1��X��ij�־����仯ѧʽʱ��ʾΪKC8��
=8��1��X��ij�־����仯ѧʽʱ��ʾΪKC8��
(5)�þ�����Y����λ�ھ����Ķ��㣬ÿ����������һ�����������Z�����ӣ�����Χ�����Z�����ӹ���8����


 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з���ʽ��ʾ������һ���Ǵ��������( )
A. C2H6OB. C2H4O2C. C2H5BrD. C2H4Cl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ij��Һ�н���Cu2+��K+��SO42-��Cl-�������ӣ��������ӵ�������ΪCu2+:K+=3:4����SO42-:Cl-�ı�ֵ������
A. 3:2 B. 2��1 C. 1:8 D. �����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���������;��˵���У�����ȷ���ǣ�������
A. Fe2O3���������������
B. ��ˮ���Ե�̲���
C. Al2O3�������ͻ����
D. �����������������ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���뼰�仯�����Ӧ�������汻���ӡ�
��l������Ҫ�ĺ������������ʯ����2������Cr��������ʯ��Ϊ��ĸ�̡���̬Crԭ�Ӽ۵��ӵĹ����ʾʽΪ_____________________��
��2�����������������Ԫ���������ơ������й��������������ȷ����_______�����ţ���
A��������p������Ԫ�� B���縺�Զ���þ��
C����һ�����ܶ���þ�� D.�Ȼ����ˮ��ҺpH��С��7
��3���롢�����嶼���ɽ���ԭ�����ò�����ά�ռ�ѻ����ɣ����ܶѻ���������۵�(155lK)�������۵�(930K)�ߣ�ԭ����__________________________��
��4���Ȼ�������̬ʱ����BeC12���ӣ�a���Ͷ��۷��ӣ�BeCl2)2(b)����̬ʱ���������ͼ��ʾ����״�ṹ��c����

��a����__________������ԡ��Ǽ��ԡ������ӡ�
�ڶ��۷��ӣ�BeCl2)2��Beԭ�ӵ��ӻ���ʽ��ͬ��������ԭ�Ӷ���ͬһƽ���ϡ�b �ĽṹʽΪ________________________________ �������λ������
��c��Beԭ�ӵ��ӻ���ʽΪ__________��
���Ȼ��뾧���д��ڵ���������_____�����ţ���
A�����»��� B. �Ҽ� C.���Լ� D���Ǽ��Լ� E�����Ӽ�
��5��BeO������������ͼ��ʾ��

��BeO������ܶ�Ϊdg/cm3��������a =______nm ���г�����ʽ���ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���г������۵ġ�84������Һ������Ʒ��ʶ�������������� ����ƷΪ��ɫ��Һ���ʼ��� ��ʹ��
ʱ��ˮϡ�� ���ɶԲ;ߡ����������������Ư��dzɫ�·���������Ч�ɷݿ�����
A��Cl2 B��SO2 C��NaClO D��KMnO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£��ڹ̶��ݻ����ܱ������У����淴ӦA(g)+3B(g)![]() 2C(g)�ﵽƽ��ʱ�������ʵ����ʵ���֮����n(A)��n(B) ��n(C)=2��2��l�������¶Ȳ��䣬��2��2��1�����ʵ���֮���ٳ���A��B��C���� ��
2C(g)�ﵽƽ��ʱ�������ʵ����ʵ���֮����n(A)��n(B) ��n(C)=2��2��l�������¶Ȳ��䣬��2��2��1�����ʵ���֮���ٳ���A��B��C���� ��
A. ƽ�����������ƶ� B. ƽ�ⲻ�����ƶ�
C. C�����������С D. C�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20mL 0.2mol/L H2A��Һ�еμ�0.2 mol/L NaOH��Һ����AԪ�ص��й������ʵ����仯����ͼ��ʾ������ͼʾ�жϣ�����˵����ȷ����
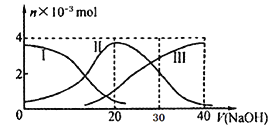
A. H2A��ˮ�еĵ��뷽��ʽ�ǣ�H2A== H++HA-��HA-![]() H++A2��
H++A2��
B. �������Ũ�ȵ�NaOH��Һ��H2A��Һ��Ϻ�����Һ��ˮ�ĵ���̶ȱȴ�ˮ��
C. ��V(NaOH)=30mLʱ����Һ�д������¹�ϵ��2c(H+)+ c(HA-)+ 2c(H2A)��c(A2-)+2c(OH-)
D. ��V(NaOH)=20mLʱ����Һ�и�����Ũ�ȵĴ�С˳��Ϊ��c(Na+)��c(HA-)��c(H+)��c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС�鹹�뽫����β��(NO��NO2)ת��Ϊ��Ҫ�Ļ���ԭ��HNO3����ԭ����ͼ��ʾ������A��BΪ�������ϡ�����˵��һ����ȷ���ǣ� ��
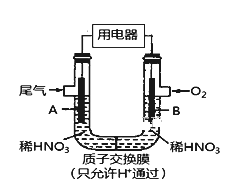
A. �õ�ع���ʱ�����ӵ��������·��A��B���ڵ�·��B��A�γɱպϻ�·
B. �缫B������HNO3Ũ������
C. A�缫�ķ�ӦΪ��NO2��e����H2O==NO3-��2H�� NO��3e����2H2O===NO3-��4H��
D. �õ�ع���ʱ��ÿ����11.2LO2(��״����)�����Գ�ȥ��1molNO��NO2�Ļ��β��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com