
【题目】实验室用铜制备CuSO 4 溶液有多种方案,某实验小组给出了以下三种方案:
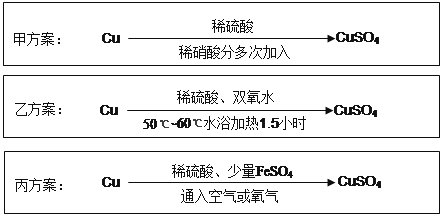
请回答有关问题:
(1)甲方案:
①写出该反应的离子方程式 ;
②为了节约原料,硫酸和硝酸的物质的量之比最佳为,n(H 2 SO 4 ):n(HNO 3 )= 。
(2)乙方案:将6.4g铜丝放到90mL 1.5mol·L -1 的稀硫酸中,控温在50℃。加入40mL 10%的H2O2,反应0.5小时,升温到60℃,持续反应1小时后,经一系列操作,得CuSO 4·5H 2O 20.0g【已知有关摩尔质量:M(Cu)=64g/mol, M(CuSO4·5H 2 O) =250g/mol】。
①反应时温度控制在50℃~60℃,不宜过高的原因是 ;
②本实验CuSO4·5H 2 O的产率为 。
(3)丙方案:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO 4 ,即发生反应,生成硫酸铜。反应完全后,加物质A调节pH至4 ,然后过滤、浓缩、结晶。
①物质A可选用以下的 (填序号);
A.CaO
B.NaOH
C.CuCO 3
D.Cu 2(OH)2CO 3
E.Fe2(SO4) 3
②反应中加入少量FeSO 4 可加速铜的氧化,FeSO 4 的作用是 ;
反应过程中的的离子方程式为: 、
(4)对比甲、乙、丙三种实验方案,丙方案的优点有(写两条): 、 。
【答案】(1)①3Cu+8H + +2NO 3 - =3Cu 2+ +2NO↑+4H 2O;②3:2;
(2)①双氧水受热易分解造成损耗; ②80%;
(3)①CD;②作催化剂;4Fe2++4H++O2=4Fe3++2H2O;2Fe3++ Cu= 2 Fe2+ +Cu2+;(4)无污染;原料利用率高(或常温下反应,耗能少;原料便宜,成本低等)。
【解析】
试题分析:(1)①NO3-在酸性条件下具有强氧化性,离子反应方程式为:3Cu + 8H + + 2NO3- = 3Cu2 + + 2NO↑ + 4H2O;②按照离子反应方程式的系数投入,需要HNO3提供2molNO3-和2molH + ,,即需要硝酸2mol,硫酸3mol,因此两者的比值为3:2;
(2)①过氧化氢受热易分解,因此温度不宜过高;②乙方案发生反应方程式为:Cu + H2O2 + H2SO4 = CuSO4 + 2H2O,根据反应方程式系数,推出铜丝完全反应,因此理论上产生CuSO4·5H2O的质量为6.4×250/64g = 25g,产率20/25×100% = 80%;
(3)①物质A是调节pH,不能引入新杂质,因此选项C、D正确;②Fe2 + 具有还原性,能被氧气氧化,发生4Fe2 + + O2 + 4H + = 4Fe3 + + 2H2O,铜单质和Fe3 + 反应,发生Cu + 2Fe3 + = 2Fe2 + + Cu2 + ,因此FeSO4为催化剂;
(4)无污染;原料利用率高(或常温下反应,耗能少;原料便宜,成本低等)。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2C12)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示。常温下,S2C12是一种橙黄色液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为:2S2C12+2H2O=SO2↑+3S↓+4HCl。下列说法中错误的是
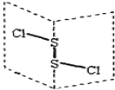
A.S2C12的结构式为Cl—S—S—Cl
B.反应中SO2是还原产物,S是氧化产物
C.S2C12为含有极性键和非极性键的分子
D.反应中,生成1molSO2,转移电子为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是
①SO2 ②CH3CH2CH=CH2③![]() ④CH3CH3
④CH3CH3
A. ①②③④ B. ③④ C. ①②④ D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示。回答下列问题:
2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示。回答下列问题:

(1)降低温度,化学反应速度_________。(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是____ _____。
(3)反应进行至20 min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a.加了催化剂
b.缩小容器体积
c.降低温度
d.增加SO3的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出257.7kJ的热量(相当于25℃、101 kPa下测得的热量)。反应的热化学方程式为 。又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与过氧化氢反应生成液态水时放出的热量是 kJ。
(2)分别取40 mL 0.50 mol/L盐酸与 0.55 mol/L NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c = 4.18 J/(g·℃)。实验时,还需测量的数据有 。
A.反应前盐酸溶液的温度
B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度
D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
某学生实验记录数据如下:
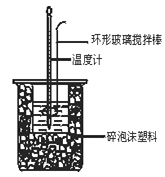
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热为ΔH = ____________。
假定该学生的操作完全同上,实验中改用100 mL 0.50 mol/L盐酸跟100 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国气象局的数据显示,2013年全国平均雾霾天数为52年来之最。形成雾霾的主要成份为:生产生活中排放的废气、汽车尾气及扬尘等。
(1)己知:CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=-4lkJ/mol,某温度下,向容积为2L的密闭容器中充入2.0molCO(g)和2.0mol H2O(g),在tmin时达到平衡,测得放出了32.8kJ热量,则tmin内用H2表示的平均反应速率为_________,由此可知在该温度下反应CO(g)+H2O(g)
CO2(g)+H2(g)△H=-4lkJ/mol,某温度下,向容积为2L的密闭容器中充入2.0molCO(g)和2.0mol H2O(g),在tmin时达到平衡,测得放出了32.8kJ热量,则tmin内用H2表示的平均反应速率为_________,由此可知在该温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的化学平衡常数为_________(保留小数点后一位)。
CO2(g)+H2(g)的化学平衡常数为_________(保留小数点后一位)。
(2)碱式硫酸铝法烟气脱硫工艺主要有以下三步
①向Al2(SO4)3溶液中投入粉末状石灰石,生成碱式硫酸铝[Al2(SO4)3Al2O3]溶液.
②碱式硫酸铝吸收SO2,Al2(SO4)3Al2O3+3SO2=Al2(SO4)3Al2(SO3)3,请写出Al2(SO4)3Al2O3与过量烧碱溶液反应的化学方程式:_________;
③将Al2(SO4)3Al2 (SO3)3氧化成Al2(SO4)3,可选用氧化剂为_________(填代号).
a.浓硫酸 b.KMnO4溶液 C.5%的H2O2溶液 d.空气
该步反应的目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A.为防止水污染,可用O3替代Cl2作饮用水消毒剂
B.实验室可用浓硫酸干燥SO2气体
C.含H2SO4的废水用BaCl2处理后不可直接排放
D.Al2(SO4)3,可除去碱性废水及酸性废水中的悬浮颗粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将氨水与氯化铵溶液混合得到 c(NH3·H2O)+c(NH4+) = 0.1mol·L-1的混合溶液。溶液中c(NH3·H2O)、c(NH4+)与pH的关系如图所示。下列有关离子浓度关系叙述一定正确的是

A. W点表示溶液中:c(NH4+) +c(H+) =c(Cl-)+c(OH-)
B. pH=10.5溶液中:c(Cl-)+c(OH-)+c(NH3·H2O)<0.1mol·L-1
C. pH=9.5溶液中:c(NH3·H2O)>c(NH4+)>c(OH-)>c(H+)
D. 向W点所表示1L溶液中加入0.05molNaOH固体(忽略溶液体积变化):c(Cl-)>c(Na+)>c(OH-)>c(NH4+) >c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下几种有机物:
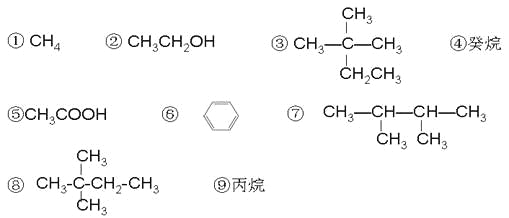
请利用上述给出的物质按要求回答下列问题:
(1)相对分子质量为44的烷烃的结构简式为 ;
(2)分子中含有14个氢原子的烷烃的分子式是 ;
(3)与③互为同分异构体的是 (填序号);
(4)具有特殊气味,常作萃取剂的有机物在铁作催化剂的条件下与液溴发生一取代反应的化学方程式 ;
(5)用“>”表示①③④⑨熔沸点高低顺序: (填序号);
(6)有机物②在加热条件下和CuO反应的化学方程式 ;
(7)在120℃,1.01×105Pa条件下,某种气态烃与足量的O2完全反应后,测得反应前后气体的体积没有发生改变,则该烃是 (填序号);它与⑧互为 关系;
(8)有机物⑤和②在一定条件下发生反应的化学方程式是 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com