
【题目】下列离子方程式书写正确的是 ![]() 。
。
A.![]() 溶于足量稀
溶于足量稀![]() :
:![]()
B.用食醋检验牙膏中碳酸钙的存在:![]()
C.![]() 酸性溶液放在空气中变质:
酸性溶液放在空气中变质:![]()
D.电解![]() 水溶液的离子方程式: 2Cl-+2H2O
水溶液的离子方程式: 2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】下列现象或事实可用同一原理解释的是
A.浓硫酸和浓盐酸长期暴露在空气中浓度降低
B.亚硫酸钠溶液和氯化铝溶液在空气中蒸干不能得到对应的溶质
C.漂白粉、活性炭、![]() 都能使红墨水褪色
都能使红墨水褪色
D.![]() 和
和![]() 溶液使酸性高锰酸钾的紫色褪去
溶液使酸性高锰酸钾的紫色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合氯化铝晶体是介于AlCl3和A1(OH)3之间的一种水溶性无机高分子聚合物,其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产工艺流程如图:
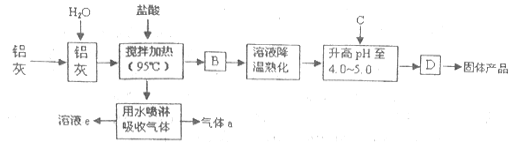
(1)反应中副产品a是___(用化学式表示);
(2)升高pH至4.0~4.5的目的是__;
(3)生产过程中可循环使用的物质是__(用化学式表示);
(4)为使得到的晶体较纯净,生产过程中使pH升高的C物质可选用___(填编号);
a.NaOH b.Al c.氨水 d.A12O3 e.NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氨与水性质相似,也存在微弱的电离:2NH3![]() NH4++NH2—,其离子积常数K=c(NH4+)·c(NH2—)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是
NH4++NH2—,其离子积常数K=c(NH4+)·c(NH2—)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是
A. 液氨的电离平衡 B. 液氨的离子积常数
C. c(NH4+) D. c(NH2—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某温度时,在0.5L密闭容器中,某一可逆反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析可得:
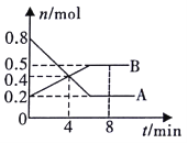
(1)该反应的化学方程式为___。
(2)若降低温度,则该反应的逆反应速率___。(填“加快”“减慢”或“不变”)。
(3)第4min时,正、逆反应速率的大小关系为:v(正)_v(逆)(填“>”、“<”或“=”)。
(4)反应至4min时,A的转化率为__。
(5)能判断该反应在一定温度下达到化学平衡状态的依据是__(填字母代号)。
A.v(A)=2v(B)
B.容器内压强不再发生变化
C.容器内气体密度不再发生变化
D.B的体积分数不再发生变化
E.容器内气体原子总数不再发生变化
F.相同时间内消耗2nmol的A的同时生成nmol的B
II.已知某可逆反应:aA(g)+bB(g)![]() cC(g)+dD(g)。请回答下列问题:
cC(g)+dD(g)。请回答下列问题:
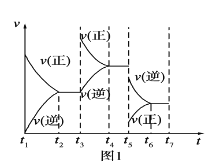

(1)根据实验测定结果,描绘出了该反应达到平衡状态时及改变外界条件后,反应速率与时间的关系图像(如图1所示),有利于提高D产量的变化过程是图像中的__段;引起该变化过程的外界条件是__。
(2)根据实验测定结果描绘出了图2。由此图像可以得出,升高温度,上述平衡将向__(填“正反应”、“逆反应”)方向移动,K值__(填“增大”、“减小”、“不变”);反应计量数之间的关系:a+b__c+d(填“大于”、“小于”、“等于”或“不确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,AgX(X=Cl、Br)的溶度积与c(Ag+)和c(X-)的相互关系如下图所示,其中A线表示AgCl,B线表示AgBr,已知p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-)。下列说法正确的是( )

A. c点可表示AgCl的不饱和溶液
B. b点的AgCl溶液加入AgNO3晶体可以变成a点
C. t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K=10-4
AgBr(s)+Cl-(aq)平衡常数K=10-4
D. t℃时,取a点的AgCl溶液和b点AgBr溶液等体积混合,会析出AgBr沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。Q点时欲使溶液恢复到起始状态,可向溶液中加入
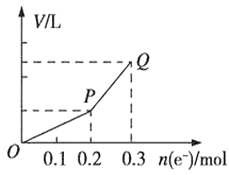
A. 0.1 mol CuO
B. 0.1 mol CuCO3
C. 0.1 mol Cu(OH)2
D. 0.05 mol Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化阿托醛![]() 是一种重要的化工原料,其合成路线如下:
是一种重要的化工原料,其合成路线如下:
(1)氢化阿托醛被催化氧化后的含氧官能团的名称是____________.
(2)在合成路线上②③的反应类型分别为②_____________③________________.
(3)反应④发生的条件是_____________________.
(4)由![]() 反应的化学方程式为_______________________________
反应的化学方程式为_______________________________
(5)1mol氢化阿托醛最多可和____mol氢气加成,1mol氢化阿托醛发生银镜反应可生成________molAg.
(6)D与有机物X在一定条件下可生成一种相对分子质量为178的酯类物质,则X的结构简式为________.D有多种同分异构体,能满足苯环上有两个取代基,且能使FeCl3溶液显紫色的同分异构体有______种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2二溴乙烷的制备原理是:CH3CH2OH![]() CH2=CH2+H2O CH2=CH2+Br2→ Br2CH2一CH2Br
CH2=CH2+H2O CH2=CH2+Br2→ Br2CH2一CH2Br
某课题小组用下图所示的装置制备1,2-二溴乙烷。

回答下列问题
(1)组装仪器后进行该实验前必须进行的操作是_________。
(2)装置B的作用是_______。
(3)三颈烧瓶内加入一定量的乙醇一浓硫酸混合液和少量粗砂,其加入粗砂目的是_______,仪器E的名称是_________________。
(4)装置C内发生的主要反应的离子方程式为__________________________。
(5)加热三颈烧瓶前,先将C与D连接处断开,再将三颈烧瓶在石棉网上加热,待温度升到约120℃时,连接C与D,并迅速将A内反应温度升温至160-180℃,从滴液漏斗中慢慢滴加乙醇一浓硫酸混合液,保持乙烯气体均匀地通入装有3.20ml液溴(![]() 3g/cm3)和3ml水的D中试管,直至反应结束。
3g/cm3)和3ml水的D中试管,直至反应结束。
①将C与D连接处断开的原因是_____________________,
②判断反应结束的现象是______________________________。
(6)将粗品移入分液漏斗,分别用水、氢氧化钠溶液、水洗涤,产品用无水氯化钙干燥,过滤后蒸馏收集129-133℃馏分,得到7.896g1,2-二溴乙烷。1,2-二溴乙烷的产率为___________。
(7)下列操作中,不会导致产物产率降低的是________ (填正确答案的标号)
a.乙烯通入溴水时速率太快 b.装置E中的NaOH溶液用水代替.
c.去掉装置D烧杯中的水 d.实验时没有C装置 e. D中的试管里不加水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com