
【题目】已知有以下物质相互转化
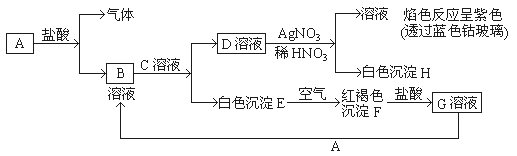
试回答:(1)写出B的化学式_________,D的化学式 ______。
(2)写出由E转变成F的化学方程式 ______________。
(3)写出G转化成B的离子方程式 ___________;
【答案】FeCl2 KCl 4 Fe(OH)2+O2+2 H2O=4 Fe(OH)3 2Fe3++ Fe= 3Fe2+
【解析】
白色沉淀E在空气中能被氧化生成红褐色沉淀F,说明E为Fe(OH)2,F为Fe(OH)3,Fe(OH)3与盐酸反应生成FeCl3,即G为FeCl3,G与A反应生成B,B与C反应可得Fe(OH)2,说明A为Fe,B为FeCl2,C中存在OH-,D与硝酸银溶液发生反应生成白色沉淀H为氯化银,溶液进行焰色反应,透过蓝色的钴玻璃看到紫色,说明C中存在K+,即C为KOH,D为KCl,据此回答问题。
由分析可知A为Fe,B为FeCl2,C为KOH,D为KCl,E为Fe(OH)2,F为Fe(OH)3;
(1)B的化学式为FeCl2,D的化学式KCl;
(2)Fe(OH)2变为Fe(OH)3的方程式为:4 Fe(OH)2+O2+2 H2O=4 Fe(OH)3;
(3)FeCl3转化成FeCl2的方程式为:2FeCl3+ Fe= 3FeCl2,离子反应为:2Fe3++ Fe= 3Fe2+。


科目:高中化学 来源: 题型:
【题目】近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展,像电一样,氢是一种需要依靠其他能源如石油、煤、原子能等的能量来制取的所谓“二级能源”,而存在于自然界的可以提供现成形式能量的能源称为一级能源,如煤、石油、太阳能和原子能。
(1)氢气燃烧时耗氧量小,发热量大。已知,热化学方程式:
C(g)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是________。
(2)氢能源有可能实现能源贮存,也有可能实现经济、高效的输送。研究表明在过渡金属型氢化物(又称间充氢化物)中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如LaH2.76、TiH1.73、CeH2.69、ZrH1.98、PrH2.85、TaH0.78。已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为10.64g·cm-3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素是形成单质及其化合物种类最多的元素。回答下列问题:
(1)碳能与氢、氮、氧三种元素构成化合物CO(NH2)2,该分子中各元素的电负性由大到小的顺序为_________,其中C原子的杂化方式为__________,该物质易溶于水的主要原因是_______________。
(2)CO是碳元素的常见氧化物,与N2互为等电子体,则CO的结构式为_______;CO可以和很多过渡金属形成配合物,如Ni(CO)4,写出基态Ni原子的电子排布式__________。
(3)碳的某种晶体为层状结构,可与熔融金属钾作用。钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图①所示,则其化学式可表示为__________

(4)图②为碳的一种同素异形体C60分子,每个C60分子中含有σ键的数目为________。
(5)图③为碳的另一种同素异形体金刚石的晶胞,其中原子坐标参数A为(0,0,0),B为(1/2,0,1/2),C为(1/2,1/2,0);则D原子的坐标参数为__________。
(6)立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼的密度是___________g·㎝-3(列出计算式即可,阿伏加徳罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知M是短周期金属元素,X和Y是短周期非金属元素,且X、M、Y的原子序数依次增大。三者组成的物质 M3XY(可视为M2X MY)是一种良好的离子导体。研究者在常压下利用下列反应合成M3XY:2M +2MXA + 2MY==2M3XY + A2。其中常温常压下A2是无色无味气体,已知上述反应中消耗0.92 g M的单质可得到标准状况下448 mL的A2。下列有关说法正确的是( )
A.X位于第二周期第IVA族
B.简单离子半径:Y > M > X
C.MXA是共价化合物
D.M3XY溶于水后溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置模拟“侯氏制碱法”,通过制备的NH3和CO2,与饱和食盐水反应先制备NaHCO3。下列说法正确的是( )
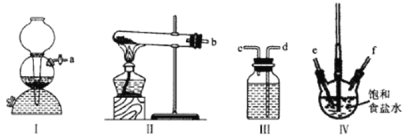
A.实验时装置Ⅰ产生的气体应先通入到装置Ⅳ中
B.装置Ⅲ中的试剂为浓硫酸
C.导管口的连接顺序为a-e-f-d-c-b
D.实验过程中,装置Ⅳ内会出现浑浊现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B.FeSO4溶液与氨水反应的离子方程式:Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+
C.酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上处理有机废水的一种方法是:在调节好pH和Mn2+浓度的废水中加入H2O2,使有机物氧化降解。现设计如下对比实验(实验条件见下表),实验测得有机物R浓度随时间变化的关系如下图所示。下列说法正确的是
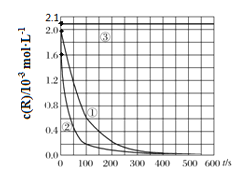
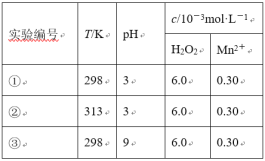
A.313K时,在0~100s内有机物R降解的平均速率为:0.014 mol·L-1·s-1
B.对比①②实验,可以得出温度越高越有利于有机物R的降解
C.对比①②实验,可以发现在两次实验中有机物R的降解百分率不同
D.通过以上三组实验,若想使反应停止,可以向反应体系中加入一定量的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吗替麦考酚酯主要用于预防同种异体的器官排斥反应,其结构简式如下图所示。
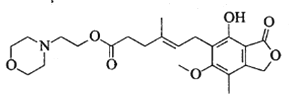
下列说法正确的是
A. 吗替麦考酚酯的分子式为C23H30O7N
B. 吗替麦考酚酯可发生加成、取代、消去反应
C. 吗替麦考酚酯分子中所有碳原子一定处于同一平面
D. 1mol吗替麦考酚酯与NaOH溶液充分反应最多消耗3mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B、C均为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去)。
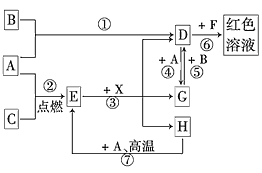
(1)在反应①~⑦中,不属于氧化还原反应的是________(填编号)。
(2)写出③的离子方程式:________________
(3)反应⑦的化学方程式为____;该反应中每消耗0.3 mol的A,可转移电子_________mol。在解决此题时的关键一步是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com