
【题目】用含FeCl3、FeCl2、CuCl2的混合溶液和空气可吸收H2S并回收S,且能实现回收液的循环,其物质转化关系如图。下列有关说法错误的是
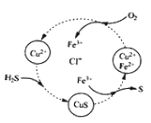
A.氢、氯、铜三元素的化合价未发生改变
B.转化过程中包含三步化学反应
C.转化过程中还原剂为H2S和FeCl2
D.总反应可表示为:2H2S+O2→ 2S+2H2O
【答案】C
【解析】
A. 由图可知反应过程中铜都是+2价,氢都是+1价,氯是-1价,所以氢、氯、铜三元素的化合价未发生改变,故A正确;
B.由图可知转化为:CuCl2+H2S=CuS↓+2HCl,2FeCl3+CuS=S↓+2FeCl2+CuCl2,4FeCl2+O2+4HCl=4FeCl3+2H2O分三步完成,故B正确;
C. H2S和FeCl2的反应复分解反应,而非氧化还原反应,H2S不作还原剂,故C错误;
D. 由图可知转化为:CuCl2+H2S=CuS↓+2HCl①,2FeCl3+CuS=S↓+2FeCl2+CuCl2②,4FeCl2+O2+4HCl=4FeCl3+2H2O③分三步完成,将三个方程①+2②+③得2H2S+O2→2S+2H2O,所以总反应可表示为:2H2S+O2→2S+2H2O,故D正确;
故选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有机物X和Y可作为“分子伞”给药载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)。
X(C24H40O5):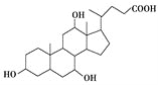
Y:H2NCH2CH2CH2NHCH2CH2CH2CH2NH2
下列叙述错误的是( )
A.1 mol X在浓硫酸作用下发生消去反应,最多生成3 mol H2O
B.1 mol Y发生类似酯化的反应,最多消耗2 mol X
C.X与足量HBr反应,所得有机物的分子式为C24H37O2Br3
D.Y与癸烷的分子链均呈锯齿形,但Y的极性较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;② 向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③ 向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+ Cl-(aq)
Ag+(aq)+ Cl-(aq)
B.滤液b中不含有Ag+
C.③中颜色变化说明AgCl 转化为AgI
D.实验可以证明AgI比AgCI更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠俗称纯碱,其用途很广。实验室中,用碳酸氢铵和饱和食盐水可制得纯碱。
(1)饱和食盐水所用的原料粗盐主要来自于海洋,从海水中得到粗盐我们通常用的方法是_______。
(2)所得的粗盐(含Ca2+、Mg2+、SO42-)需要提纯,需要加入足量NaOH、BaCl2、Na2CO3溶液将杂质离子除去,随后过滤并加入盐酸调pH至7。其中先用BaCl2,再用Na2CO3的原因是______。
(3)饱和食盐水除用于制纯碱,也是氯碱工业的原料。氯碱工业中电解饱和食盐水的方程式为_______。
(4)测试纯碱产品中NaHCO3含量的方法是:用_______(定量仪器)称取纯碱样品1.144g,用蒸馏水溶解,加入0.500mol/L的HCl溶液100mL,再加1-2滴酚酞,继续用0.500mol/L标准氢氧化钠溶液滴定。当滴定至溶液由_____色变_____色,半分钟不变色为滴定终点。
(5)若上述过程中共消耗氢氧化钠58.00mL,纯碱样品中NaHCO3质量分数为_____。(保留3位小数)
(6)如果装氢氧化钠的滴定管滴定结束读数时有漏液情况,会导致测定结果______(选填“偏大”、“偏 小”、“不受影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
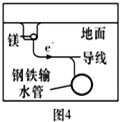
【题目】下列与金属腐蚀有关的说法正确的是( ).
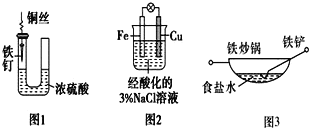
A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,形成了原电池,加速了铁锅、铁铲的腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化硫(S2C12)的结构式为Cl—S—S—Cl,常温下为浅黄色油状液体,遇水即分解:2S2Cl2+2H2O→4HCl+SO2↑+3S↓。下列有关此反应的说法正确的是
A.S2C12做氧化剂,H2O做还原剂
B.每生成l mol SO2转移4 mol电子
C.氧化产物与还原产物的物质的量之比为l:3
D.每生成48g硫会断裂2mol氢氧键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期主族元素原子半径与原子序数的关系。下列说法错误的是
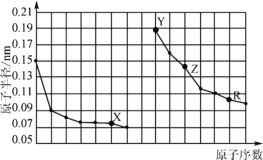
A.X、R的最高化合价相同
B.电解熔融的X与Z构成的化合物可以得到单质Z
C.X、Y形成的化合物中阳离子与阴离子的个数比一定是2:1
D.Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。有关说法正确的是( )
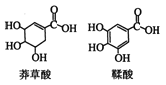
A.等浓度的两种酸其酸性相同
B.两种酸都能与溴水发生加成反应
C.鞣酸分子与莽草酸分子相比多了两个碳碳双键
D.鞣酸能与Fe3+发生显色反应,而莽草酸不能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com