
【题目】下表为元素周期表的一部分,根据表中序号对应元素回答有关问题:
族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
(1)表中元素,化学性质最不活泼的是___,只有负价而无正价的是___,原子半径最大的是___;(填写元素符号);
(2)表中能形成两性氢氧化物的元素是___(填元素符号),分别写出该元素的氢氧化物与⑥、⑨的最高价氧化物对应水化物反应的离子方程式分别是___、___。
(3)元素①组成的单质的电子式为___;用电子式表示⑥的氢化物的形成过程___。
(4)②和③的单质加热时反应生成物质X,其化学式为___,该物质中含有的化学键的类型为___。
【答案】Ar O K Al Al(OH)3+3H+=Al3++3H2O Al(OH)3+OH-=AlO2-+2H2O ![]()
![]() Na2O2 离子键、非极性共价键
Na2O2 离子键、非极性共价键
【解析】
根据元素在周期表中的位置可知①为N元素,②为O元素,③为Na元素,④为Al元素,⑤为Si元素,⑥为S元素,⑦为Cl元素,⑧为Ar元素,⑨为K元素,⑩为Br元素,结合元素在周期表中的位置以及元素周期律的递变规律可解答该题。
(1)稀有气体性质最不活泼,所以化学性质最不活泼的是Ar;O元素一般只有负化合价,没有正化合价;同周期从左到右原子半径逐渐减小,同一主族从上到下原子半径逐渐增大,所以前四周期中原子半径最大的是K元素;
(2)Al元素能形成两性氢氧化物,⑥⑨最高价氧化物的水化物反应分别是KOH、H2SO4,反应方程式分别为Al(OH)3+KOH=NaAlO2+2H2O、2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,离子方程式分别为:Al(OH)3+3H+=Al3++3H2O ;Al(OH)3+OH-=AlO2-+2H2O;
(3)元素①组成的单质是N2,电子式为:![]() ,⑥的氢化物是H2S,用电子式表示其形成过程为:
,⑥的氢化物是H2S,用电子式表示其形成过程为:![]() ;
;
(4)②和③的单质分别是钠和氧气,在加热条件下生成物质为Na2O2;由钠离子和过氧根形成的离子化合物,钠离子和过氧根间有离子键,过氧根内有非极性共价键。


科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A. 标准状况下,11.2L的己烷所含的分子数为0.5NA
B. 28g乙烯所含共用电子对数目为4NA
C. 1mol羟基所含电子数为7 NA
D. 现有乙烯、丙烯的混合气体共14g,其原子数为3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度为0.1 mol·L-1、体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
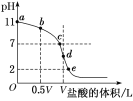
(1)该温度时NH3·H2O的电离常数K=________。
(2)滴定过程中所用盐酸的pH=________。
(3)比较b、c、d三点时的溶液中,由水电离出的c(OH-)大小顺序为____________。(填字母)
(4)在a点,将0.1 mol·L-1的NH3·H2O溶液加水稀释,下列各选项中数值变小的是________(填字母,下同)。
A.c(NH4+)/c(NH3·H2O) B.c(H+)/c(OH-)
C.c(NH4+)·c(OH-)/c(NH3·H2O) D.c(OH-)
(5)根据以上滴定曲线判断下列说法正确的是________(溶液中N元素只存在NH4+和NH3·H2O两种形式)。
A.点b所示溶液中:c(NH4+)+c(H+)=c(OH-)+c(NH3·H2O)
B.点c所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH4+)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.点d所示溶液中:c(H+)=c(OH-)+c(NH3·H2O)
(6) d点之后若继续加入盐酸至图像中的e点(不考虑NH4+水解的影响),则e点对应的横坐标为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表达正确的是( )
A. NH4++H2O=NH3·H2O+H+
B. Na2SO3+2H2O![]() 2NaOH+2H2SO3
2NaOH+2H2SO3
C. NaHCO3=Na++H++CO32-
D. BaSO4(s)![]() Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同温度下,水溶液中c(H+)与c(OH-)的关系如图所示。下列有关说法不正确的是( )
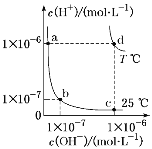
A. d点对应的食盐水pH=6,呈中性
B. 向a点对应的CH3COOH溶液中滴加NaOH溶液至b点,此时c(Na+)=c(CH3COO-)
C. a点对应的稀硫酸与c点对应的CH3COONa溶液中水的电离程度相同
D. 温度为T ℃时,0.05 mol·L-1Ba(OH)2溶液的pH=11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语的用法中,正确的是
A. BaCO3的电离方程式:BaCO3![]() Ba2++CO32-
Ba2++CO32-
B. 向酸性KI溶液中通入臭氧(O3)的离子方程式: 2I-+O3+H2O=I2+O2+2OH-
C. 向沸水中滴加饱和氯化铁溶液得到红褐色液体的化学方程式:FeCl3+3H2O![]() Fe(OH)3↓+3HCl↑
Fe(OH)3↓+3HCl↑
D. 向Ba(OH)2溶液中滴入NaHSO4溶液至恰好完全沉淀时,反应的离子方程式Ba2++OH-+SO42-+H+=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、E四种常见物质含有同一种元素,其中E是一种强酸,在一定条件下,它们有如图所示转化关系。下列推断不合理的是

A. X可能是一种氢化物
B. Y可能直接转化为E
C. Y不可能转化为X
D. 若X是单质,则X转化为Y的反应可能是化合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将11.2g铁投入200mL某浓度的盐酸中,铁和盐酸恰好完全反应。求:
(1)所用盐酸中HCl的物质的量浓度?___
(2)反应中生成的H2在标准状况下的体积为多少升?___
(3)取100mL该浓度的盐酸与100mL5mol/L盐酸混合均匀,再加水稀释至250mL,求此时盐酸的物质的量浓度?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示的实验回答问题。
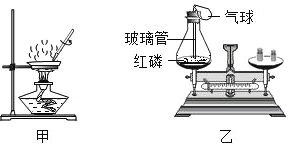
(1)甲为蒸发溶液的实验。加热时若不搅拌,造成的后果是________;当观察到________时,停止加热。
(2)乙为通过红磷燃烧前后质量的测定验证质量守恒定律的实验。用红热玻璃管引燃红磷,实验现象是红磷燃烧,产生________,放出大量热。实验中气球的作用除了使装置密闭之外,还可以防止________;实验时若取用红磷的量不足,对实验的结果________ (选填“有”或“没有”)影响。
(3)用图1装置进行实验,先后将溶液快速全部推入,测得一段时间内压强变化如图2所示。
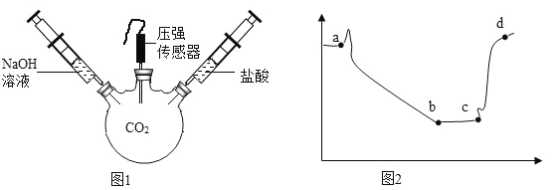
①先推入的溶液是________
②be段压强不变,原因是________
③cd段压强变大,用化学方程式解释:________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com