
【题目】由相同金属电极及其不同浓度的盐溶液组成的电池,称浓差电池,电子由溶液浓度较小的一极流向浓度较大的一极。如图所示装置中,X电极与Y电极初始质量相等。进行实验时,先闭合K2,断开K1,一段时间后,再断开K2,闭合K1,即可形成浓差电池,电流计指针偏转。下列不正确的是( )
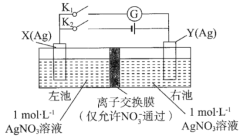
A. 充电前,该电池两电极存在电势差
B. 放电时,右池中的NO3-通过离了交换膜移向左池
C. 充电时,当外电路通过0.1 mol电子时,两电极的质量差为21.6g
D. 放电时,电极Y为电池的正极
【答案】A
【解析】
先闭合K2,断开K1,形成电解池,X电极是阴极,电极反应是Ag++e-=Ag,Y是阳极,电极反应式是Ag-e-=Ag+,NO3-通过离子交换膜进入右池,所以左池浓度小于右池;再断开K2,闭合K1,形成原电池,电子由溶液浓度较小的一极流向浓度较大的一极,X是负极、Y是正极。
A. 充电前,左右两池浓度相同,该电池两电极不存在电势差,故A错误;
B. 放电时,电子由溶液浓度较小的一极流向浓度较大的一极,X是负极、Y是正极,右池中的NO3-通过离了交换膜移向左池,故B正确;
C. 充电时,当外电路通过0.1 mol电子时,X电极消耗0.1molAg,Y电极生成0.1molAg,所以两电极的质量差为21.6g,故C正确;
D. 电子由溶液浓度较小的一极流向浓度较大的一极,充电后左池浓度小于右池,所以放电时,电极Y为电池的正极,故D正确;选A。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
A. NH3![]() NO2
NO2![]() HNO3B. Al
HNO3B. Al![]() NaAlO2(aq)
NaAlO2(aq)![]() NaAlO2(s)
NaAlO2(s)
C. Fe![]() Fe2O3
Fe2O3![]() FeD. AgNO3(aq)
FeD. AgNO3(aq)![]() [Ag(NH3)2OH(aq)]
[Ag(NH3)2OH(aq)]![]() Ag
Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、N、X、Y四种主族元素在周期表里的相对位置如下图所示,已知它们的原子序数总和为46。

(1)M与Y形成的化合物中含________键,属__________分子。(填“极性”或“非极性”)
(2)N元素形成的单质分子中的化学键类型及数目是__________________(填“σ键”或“π键”)。在化学反应中________易断裂。
(3)由N、Y的氢化物相互作用所生成的物质的电子式为_________________。其中的化学键有__________________________。
(4)写出M单质与X元素最高价氧化物对应的水化物反应的化学方程式_____________。
(5)核电荷数比X元素少8的元素可形成多种粒子,按要求填入空格中:
质子数 | 16 | 16 | 16 |
电子数 | 16 | 17 | 18 |
化学式 | _______ | ________ | ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究处理NOx、SO2,对环境保护有着重要的意义。回答下列问题:
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:① SO2(g) + NH3H2O(aq) =NH4HSO3(aq) △H1 = a kJmol-1;② NH3H2O(aq) + NH4HSO3(aq) =(NH4)2SO3(aq) + H2O(l)△H2 = b kJmol-1;③ 2(NH4)2SO3(aq) + O2(g) =2(NH4)2SO4(aq) △H3= c kJmol-1,则反应 2SO2(g) + 4NH3H2O(aq) + O2(g) =2(NH4)2SO4(aq) + 2H2O(l) △H = ______。
(2)NOx的排放主要来自于汽车尾气,有人利用反应C (s) + 2NO(g)![]() N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
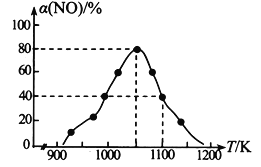
①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是_________________________; 在1100K 时,CO2的体积分数为______。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=________(已知:气体分压=气体总压×体积分数)。
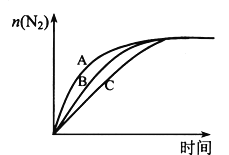
(3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。在相同条件下,选用A、B、C三种不同催化剂进行反应,生成 N2的物质的量与时间变化关系如图所示,其中活化能最小的是_________(填字母标号)。
(4)在汽车尾气的净化装置中 CO和NO发生反应:2NO(g) + 2CO(g)![]() N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。实验测得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆为速率常数,只与温度有关)。
N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。实验测得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_____(填" >”、“< ”或“=”) k逆增大的倍数。
②若在1L 的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =_____(保留2位有效数字)。
=_____(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,N表示粒子数。下列叙述正确的是( )
A. 在标准状况下2.24LCCl4中含有的C—Cl键数为0.4NA
B. 将1mol Cl2通入水中,则N(HClO)+N(Cl)+N(ClO)=2NA
C. 将CO2通过Na2O2使其质量增加a g时,反应转移的电子数为aNA/14
D. 3.0g含甲醛(HCHO)的冰醋酸中含有的原子总数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物H ( )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:

已知:①C、D、G均为芳香族化合物,分子中均只含两种不同化学环境的氢原子。
②Diels-Alder反应:![]() 。
。
(1)生成A的反应类型是_______。D的名称是_______。F中所含官能团的名称是_______。
(2)B的结构简式是_______;“B→C”的反应中,除C外,另外一种产物是_______。
(3)D+G→H的化学方程式是______。
(4)Q是D的同系物,相对分子质量比D大14,则Q可能的结构有______种,其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的结构简式为______(任写一种)。
(5)已知:乙炔与1,3-丁二烯也能发生Diels-Alder反应。请以1,3-丁二烯和乙炔为原料,选用必要的无机试剂合成 ,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 | H2C2O 4 | K1=5.4×10-2 K2=5.4×10-5 | H2S | K1=1.3×10-7 K2=7.1×10-15 |
HClO | 3×10-8 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是__________。
(2)常温下0.1 molL-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______(填序号)。
A.c(H+) B. c(H+)/c(CH3COOH) C. c(H+)/c(OH-) D. c(OH-)
(3)0.1 molL-1的H2C2O4溶液与0.1 molL-1的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为______________。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的最浓度的大小关系是:CH3COONa______NaClO,两溶液中:[c(Na+)-c(ClO-)]______[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(5)向0.1 molL-1CH3COOH 溶液中滴加 NaOH 溶液至 c(CH3COOH): c(CH3COO-)=5 : 9,此时溶液pH=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,m A(g)+n B(g) ![]() p C(g)反应达平衡时,测得 c(A)为 0.5molL1,温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得 c(A)为 0.3molL1,则下列判断中正确的是
p C(g)反应达平衡时,测得 c(A)为 0.5molL1,温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得 c(A)为 0.3molL1,则下列判断中正确的是
A. 平衡向正反应方向移动 B. 物质B的转化率减小
C. m + n <p D. 物质C的体积分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】POCl3是重要的基础化工原料,广泛用于制药、染料、表面活性剂等行业。一种制备POCl3的原理为:PCl3+Cl2+SO2=POCl3+SOCl2。某化学学习小组拟利用如下装置在实验室模拟制备POCl3。有关物质的部分性质如下:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其它 |
PCl3 | -93.6 | 76.1 | 1.574 | 遇水强烈水解,易与氧气反应 |
POCl3 | 1.25 | 105.8 | 1.645 | 遇水强烈水解,能溶于PCl3 |
SOCl2 | -105 | 78.8 | 1.638 | 遇水强烈水解,加热易分解 |

(1)仪器甲的名称为______________,与自来水进水管连接的接口编号是________________。(填“a”或“b”)。
(2)装置C的作用是___________________,乙中试剂的名称为____________________。
(3)该装置有一处缺陷,解决的方法是在现有装置中再添加一个装置,该装置中应装入的试剂为_________(写名称)。若无该装置,则可能会有什么后果?请用化学方程式进行说明__________________________。
(4)D中反应温度控制在60-65℃,其原因是_______________。
(5)测定POCl3含量。①准确称取30.70gPOCl3产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解;②将水解液配成100.00mL溶液,取10.00mL溶液于锥形瓶中;③加入10.00mL3.200mol/LAgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;④以Fe3+为指示剂,用0.2000mol/LKSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00mLKSCN溶液。
①滴定终点的现象为____________________,用硝基苯覆盖沉淀的目的是__________________。
②反应中POCl3的百分含量为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com