
����Ŀ��(1)25��ʱ��CH3COOH��CH3COONa�Ļ����Һ������û��ҺpH=6������Һ��c(CH3COO��)��c(Na+)=________(��ȷ��ֵ)��
(2)25��ʱ����a molL��1�Ĵ�����b molL��1�������Ƶ������ϣ���Ӧ����Һǡ�������ԣ���a��b��ʾ����ĵ���ƽ�ⳣ��Ϊ___________________________________��
(3)д��ʹ����ĭ�����ʱ������Ӧ�����ӷ���ʽ_________________________________��
(4)������������ʵ���Ũ�ȵĴ��������������Һ��Ϻ���Һ��_______(������������������������������)����Һ��c(Na��) _______c(CH3COO��)(���� >�� �� ����������<��)��
(5)pH��3�Ĵ����pH��11������������Һ�������Ϻ���Һ��_______(������������������������������)��
(6)25��ʱ�����ΪVa��pH=a��ijһԪǿ����Һ�����ΪVb��pH=b��ijһԪǿ����Һ���Ȼ�Ϻ���Һ��pH=7����֪b=2a��Va��Vb����a��ȡֵ��ΧΪ________��
(7)����a������ b������ c�������������ȫ�кͺ������ʵ�����NaOH����Һ��������ͬpH��������������Һ������ɴ�С��˳����______��
���𰸡�9.9��10-7mol��L��1 ![]() Al3++3HCO3��= Al(OH)3��+ 3CO2�� ���� �� ����
Al3++3HCO3��= Al(OH)3��+ 3CO2�� ���� �� ���� ![]() <a<
<a<![]() a=b��c
a=b��c
��������
(1) pH=6����c(H+)=10-6mol/L��c(OH-)=10-8mol/L�����õ���غ㣬�������Һ��c(CH3COO��)��c(Na+)= c(H+)-c(OH-)���������ݼ��ɵó������
(2)25��ʱ����a molL��1�Ĵ�����b molL��1�������Ƶ������ϣ���Ӧ����Һǡ�������ԣ���ʱc(CH3COO-)= c(Na+)=![]() b molL��1��c(H+)=10-7mol/L��c(CH3COOH)=
b molL��1��c(H+)=10-7mol/L��c(CH3COOH)=![]() (a-b )
(a-b )
molL��1����a��b��ʾ����ĵ���ƽ�ⳣ��ΪKa=![]() ���������ݼ���������
���������ݼ���������
(3)��ĭ�����ʱ�����ķ�Ӧ��Al3+��HCO3��˫ˮ�ⷴӦ��
(4)������������ʵ���Ũ�ȵĴ��������������Һ��Ϻ����ɴ�������Һ��CH3COO-+H2O![]() CH3COOH+OH-���ɴ˿�ȷ����Һ�����ʼ���Һ��c(Na��)��c(CH3COO��)�Ĺ�ϵ��
CH3COOH+OH-���ɴ˿�ȷ����Һ�����ʼ���Һ��c(Na��)��c(CH3COO��)�Ĺ�ϵ��
(5)pH��3�Ĵ����pH��11������������Һ�������Ϻ���Һ�д��������CH3COOH![]() CH3COO-+H+���ɴ˿�ȷ����Һ�����ʡ�
CH3COO-+H+���ɴ˿�ȷ����Һ�����ʡ�
(6)25��ʱ�����ΪVa��pH=a��ijһԪǿ����Һ�����ΪVb��pH=b��ijһԪǿ����Һ���Ȼ�Ϻ���Һ��pH=7����֪b=2a��Va��Vb����Va��10-a= Vb��10-(14-b)��![]() 10a+b-14���ɴ����a������b>7�������a>
10a+b-14���ɴ����a������b>7�������a>![]() ��������a��ȡֵ��Χ��
��������a��ȡֵ��Χ��
(7)����������pH��ͬ��������NaOH��Һ�������ͬ����Ϊ���������ᣬ������ͬpHʱ�����ʵ����������NaOH��Һ���������ɴ˿�ȷ����ȫ�кͺ������ʵ�����NaOH����Һ����������ͬpH��������������Һ������ɴ�С��˳��
(1) pH=6����c(H+)=10-6mol/L��c(OH-)=10-8mol/L�����õ���غ㣬�������Һ��c(CH3COO��)��c(Na+)= c(H+)-c(OH-)=10-6mol/L-10-8mol/L=9.9��10-7mol��L��1����Ϊ��9.9��10-7mol��L��1��
(2)25��ʱ����a molL��1�Ĵ�����b molL��1�������Ƶ������ϣ���Ӧ����Һǡ�������ԣ���ʱc(CH3COO-)= c(Na+)=![]() b molL��1��c(H+)=10-7mol/L��span>c(CH3COOH)=
b molL��1��c(H+)=10-7mol/L��span>c(CH3COOH)=![]() (a-b )
(a-b )
molL��1����a��b��ʾ����ĵ���ƽ�ⳣ��ΪKa=![]() =
=![]() ������
������![]() ��
��
(3)��ĭ�����ʱ�����ķ�Ӧ��Al3+��HCO3��˫ˮ�ⷴӦ����Ӧ�����ӷ���ʽΪAl3++3HCO3��= Al(OH)3��+ 3CO2������Ϊ��Al3++3HCO3��= Al(OH)3��+ 3CO2����
(4)������������ʵ���Ũ�ȵĴ��������������Һ��Ϻ����ɴ�������Һ��CH3COO-+H2O![]() CH3COOH+OH-���ɴ˿�ȷ����Һ�Լ��ԣ���Һ��c(Na��)>c(CH3COO��)����Ϊ�����ԣ�>��
CH3COOH+OH-���ɴ˿�ȷ����Һ�Լ��ԣ���Һ��c(Na��)>c(CH3COO��)����Ϊ�����ԣ�>��
(5)pH��3�Ĵ����pH��11������������Һ�������Ϻ���Һ�д��������CH3COOH![]() CH3COO-+H+����Һ�����ԡ���Ϊ�����ԣ�
CH3COO-+H+����Һ�����ԡ���Ϊ�����ԣ�
(6)25��ʱ�����ΪVa��pH=a��ijһԪǿ����Һ�����ΪVb��pH=b��ijһԪǿ����Һ���Ȼ�Ϻ���Һ��pH=7����֪b=2a��Va��Vb����Va��10-a= Vb��10-(14-b)��![]() 10a+b-14<1��a+b-14<0��3a<14��a<
10a+b-14<1��a+b-14<0��3a<14��a<![]() ������b>7�������a>
������b>7�������a>![]() ��������a��ȡֵ��ΧΪ
��������a��ȡֵ��ΧΪ![]() <a<
<a<![]() ������
������![]() <a<
<a<![]() ��
��
(7)����������pH��ͬ��������NaOH��Һ�������ͬ����Ϊ���������ᣬ������ͬpHʱ�����ʵ����������NaOH��Һ���������ɴ˿�ȷ����ȫ�кͺ������ʵ�����NaOH��Һ��������ͬpH��������������Һ������ɴ�С��˳��a=b��c����Ϊ��a=b��c��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в�������������ԭ�����͵���ʵ��
A. ����ɫ��NO2��ѹ����ɫ�ȱ�����dz
B. ���������������⻯��������ɵ�ƽ����ϵ��ѹ����ɫ����
C. ����ɫ����ˮ���պ���ɫ��dz
D. �ϳɰ���ҵʹ�ø�ѹ����߰��IJ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ���Ϊ0.5L�ļס��ҡ��������ܱ������зֱ����һ������A��B��������Ӧ��A(g)��xB(g)![]() 2C(g)���������ķ�Ӧ�¶ȡ���Ӧ����ʼ������Ӧ������C��Ũ����ʱ��仯��ϵ�ֱ���ͼ����ʾ��
2C(g)���������ķ�Ӧ�¶ȡ���Ӧ����ʼ������Ӧ������C��Ũ����ʱ��仯��ϵ�ֱ���ͼ����ʾ��
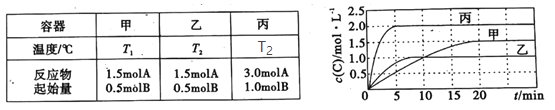
����˵����ȷ���ǣ� ��
A.T1< T2���Ҹ÷�ӦΪ���ȷ�Ӧ
B.x��2
C.��ƽ����¶Ȳ��䣬�ı��������ƽ�ⲻ�ƶ�
D.�÷�Ӧ����Ӧ�Ļ�ܴ����淴Ӧ�Ļ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧƽ���ƶ�ԭ�����������������������ҪӦ�á�
��1������������[KAl(SO4)2��12H2O]��������ˮ�����侻ˮ��ԭ����_____�������ӷ���ʽ��ʾ����
��2����ҵ����850��ʱ���ƻ�ԭ����̬�Ȼ��صķ����Ʊ������أ������ķ�Ӧ����ʽΪ��Na(l) + KCl(l)![]() NaCl(l) + K(g)�����Ʊ��ص�ԭ����_______��
NaCl(l) + K(g)�����Ʊ��ص�ԭ����_______��
��3�����ij������ˮ�к�Cr2O72�C��Ũ��Ϊ3.0��10�C4 mol��L1�������£��Ը��к����ӵĴ����������£�{��֪���̷��Ļ�ѧʽΪFeSO4��7 H2O�� Ksp [Cr(OH)3]��6.0��10�C31 }
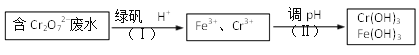
�� ����(��)�з�����Ӧ�����ӷ���ʽΪ_________��
�� �����Լ�������Լ���ķ�ˮ����仯����Cr3+��ʼ������pHΪ_________��
��4��Ϊ���о������ܽ�ƽ��ͳ���ת����ijͬѧ�������ϲ��������ʵ�顣�������ϣ�25��ʱ��Ksp (AgCl)��1.8��10�C10��Ksp (AgI)��8.3��10�C17��
�������� | ���� |
����1����2 mL 0.1 mol��L1AgNO3��Һ�м���2 mL 0.1 mol��L1 NaCl��Һ���õ���Һa�����ˡ� | ����Һb�Ͱ�ɫ����c |
����2������Һb�еμ�0.1 mol��L1 KI��Һ�� | ���ֻ��� |
����3�����ɫ����c�еμ�0.1 mol��L1 KI��Һ�� | ��ɫ������Ϊ��ɫ |
�� ��Һa�д��ڳ����ܽ�ƽ�⣨�÷���ʽ��ʾ��______________��
�� �û�ѧƽ��ԭ�����Ͳ���3�е�ʵ������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������£�0.1mol/L ��CH3COOH ��Һ����1% CH3COOH ���ӷ������룬����Һ��pH=______________������ʹ0.10mol��L-1 CH3COOH�ĵ���̶��������____________����
a.��������0.10 mol��L-1��ϡ���� b.����CH3COOH��Һ
c.��ˮϡ����0.010 mol��L-1. d.��������������
e.���������Ȼ��ƹ��� f.��������0.10 mol��L-1��NaOH��Һ
��2������������пͶ��������pH ������3 �Ĵ����������Һ�У�������ַ�Ӧ����ֻ��һ����Һ��п��ʣ�࣬�����������������V( ����)________V(����)(����>������ <�� ����=��)��
��3��0.1mol/L ��ij��H2A ��pH=4����H2A �ĵ��뷽��ʽΪ_________________��
��4��ij�¶��£�Kw=1��10-12����0.02mol/L��Ba(OH)2��Һ������ʵ���Ũ�ȵ�NaHSO4��Һ�������ϣ����û��Һ��pH=____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�ظ�(Cr)����Һ����Ҫ��Cr3+(����ɫ)��Cr(OH)4(��ɫ)��Cr2O72(�Ⱥ�ɫ)��CrO42(��ɫ)����ʽ���ڣ�Cr(OH)3Ϊ������ˮ�Ļ���ɫ���壬�ش��������⣺
(1)Cr3+��Al3+�Ļ�ѧ�������ƣ���Cr2(SO4)3��Һ����μ���NaOH��Һֱ���������ɹ۲쵽��������____________��
(2)CrO42��Cr2O72����Һ�п��ת���������£���ʼŨ��Ϊ1.0 mol��L1��Na2CrO4��Һ��c(Cr2O72)��c(H+)�ı仯��ͼ��ʾ��
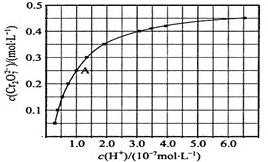
�������ӷ���ʽ��ʾNa2CrO4��Һ�е�ת����Ӧ__________��
����ͼ��֪����Һ��������CrO42��ƽ��ת����___________(������������С������������)������A�����ݣ��������ת����Ӧ��ƽ�ⳣ��Ϊ___________��
�������¶ȣ���Һ��CrO42��ƽ��ת���ʼ�С����÷�Ӧ����H_________0(������������С��������������)��
(3)+6�۸��Ļ����ﶾ�Խϴ���NaHSO3����Һ�е�Cr2O72��ԭ��Cr3+����Ӧ�����ӷ���ʽΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£����з�Ӧ�������Է����е���
A.2O3(g)=3O2(g) ��H<0
B.CaCO3(s)=CaO(s)+CO2(g) ��H>0
C.N2(g)+3H2(g) ![]() 2NH3(g) ��H<0
2NH3(g) ��H<0
D.2CO(g)=2C(s)+O2(g) ��H>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����
(1)![]() �������� ______ ��
�������� ______ ��
(2) �������� ______ ��
�������� ______ ��
(3) �ĺ��������ŵ�����___________________________________
�ĺ��������ŵ�����___________________________________
(4)ʵ��ⶨij�л���Ԫ���������ΪC:69�� H��4.6�� N��8.0����������O�����л����ʵ��ʽΪ________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ӧ�з�Ӧ����������FeCl2��FeCl3��CuCl2��Cu��
��1����������Ӧ��Ƴɵ�ԭ�����ͼ����ʾ��ش��������⣺

��ͼ��X��Һ��__��
��Cu�缫�Ϸ����ĵ缫��ӦʽΪ__��
��ԭ��ع���ʱ�������е�__�K+����Cl-�������Ͻ���X��Һ�С�
��2����������Ӧ��Ƴɵ�����ͼ����ʾ���ձ��н��������ӵ����ʵ��������ת�Ƶ����ʵ����ı仯��ϵ��ͼ������ش��������⣺
��M�ǵ�Դ��__����
��ͼ���еĢ�����__�ı仯��
�۵�����ת��Ϊ0.2molʱ�����ձ��м���__L5mol/LNaOH��Һ����ʹ���еĽ��������ӳ�����ȫ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com