
【题目】下列说法正确的是( )
A.向0.1 mol·L-1氨水中加入少量水,pH减小,![]() 减小
减小
B.同浓度的下列溶液中,① NH4HSO4 ②NH4Cl ③NH3·H2O ④CH3COONH4 ⑤NH4ClO,c(NH4+)由大到小的顺序是:①>②>④>⑤>③
C.0.1 mol·L-1 Na2CO3溶液中:c(HCO3-)=2c(H2CO3)+c(H+)-c(OH-)
D.常温下,浓度均为0.1 mol·L-1L NaA和HA溶液中pH=9,则c (HA)>c(A-)>c(Na+)>c(OH-)>c(H+)
【答案】B
【解析】
A.向0.1 mol·L-1氨水中加入少量水,促进一水合氨的电离,但溶质离子浓度降低,即c(OH-)和c(NH4+)减小,则pH减小;又Ka不变,则![]() =
=![]() 会增大,故A 错误;
会增大,故A 错误;
B. ①②④和⑤是强电解质,完全电离,③是弱电解质部分电离,所以上述溶液中c(NH4+)③最小;①中氢离子抑制酸根离子水解, ④和⑤中阴离子促进铵根离子的水解,且促进作用:⑤>④,因铵根离子个数相同的铵盐中,水解程度越小,c(NH4+)越大,所以同浓度的上述溶液中,c(NH4+)由大到小的顺序是:①>②>④>⑤>③,故B正确;
C. 0.1 mol·L-1 Na2CO3溶液中遵循质子守恒,即c(HCO3-)+2c(H2CO3)+c(H+)=c(OH-),即c(HCO3-)=c(OH-) - 2c(H2CO3)+c(H+),故C错误;
D. 常温下混合溶液的pH=9,溶液呈碱性,说明NaA水解程度大于HA电离程度,钠离子不水解,因水溶液中离子的水解和弱电解质的电离程度都较小,所以存在c(HA)>c(Na+)>c(A)>c(OH)>c(H+),故D错误;
故选:B。


科目:高中化学 来源: 题型:
【题目】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
I.(1)已知:一定条件下![]() 可被甲烷还原“纳米级”的金属铁。其反应为:
可被甲烷还原“纳米级”的金属铁。其反应为:
![]()
①此反应的化学平衡常数表达式为______
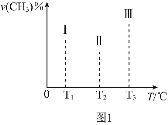
②在容积均为VL的I、II、III三个相同密闭容器中加入足量![]() ,然后分别充入amol
,然后分别充入amol![]() ,三个容器的反应温度分别为
,三个容器的反应温度分别为![]() 、
、![]() 、
、![]() 且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时
且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时![]() 的体积分数如图1所示,此时I、II、III三个容器中一定处于化学平衡状态的是______;上述反应的
的体积分数如图1所示,此时I、II、III三个容器中一定处于化学平衡状态的是______;上述反应的![]() ______
______![]() 填“大于”或“小于”
填“大于”或“小于”![]() ,该反应在______
,该反应在______![]() 填“高温”、“低温”或“任意温度”
填“高温”、“低温”或“任意温度”![]() 下可自发进行。
下可自发进行。
![]() 利用天然气为原料的一种工业合成氨简式流程图如图2:
利用天然气为原料的一种工业合成氨简式流程图如图2:
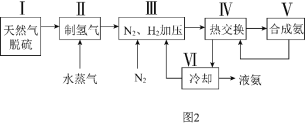
(1)步骤Ⅱ中制氢气的原理如下:Ⅰ![]() ;
;![]()
Ⅱ![]() ;
;![]()
①对于反应Ⅰ,在一定温度下的恒容容器中,表示其已达到最大化学反应限度的叙述正确的是______。
A.单位时间内1mol![]() 消耗,同时有3mol
消耗,同时有3mol![]() 生成;
生成;
B.![]() 、
、![]() 、CO的物质的量浓度相等;
、CO的物质的量浓度相等;
C.混合气体的密度再改变;
D.混合气体的压强不再改变。
②则反应![]() ;
;![]() ______
______![]() 用含
用含![]() 、
、![]() 的代数式表示
的代数式表示![]() 。
。
(2)合成氨是人类科学技术上的一项重大突破,反应原理为:![]() 在容积为10L的密闭容器中进行,起始时充入
在容积为10L的密闭容器中进行,起始时充入![]()
![]() 、
、![]()
![]() 反应在不同条件下进行,反应体系总压强随时间的变化如图3所示。
反应在不同条件下进行,反应体系总压强随时间的变化如图3所示。
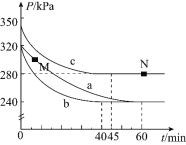
①实验a从开始至平衡时的反应速率![]() ______;实验c中
______;实验c中![]() 的平衡转化率
的平衡转化率![]() 为______。
为______。
②与实验a相比,其他两组改变的实验条件是:b______,c______。
③M点的逆反应速率![]() ______N点的正反应速率
______N点的正反应速率![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ;N点时再加入一定量
;N点时再加入一定量![]() ,平衡后
,平衡后![]() 的体积分数______
的体积分数______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,7.8g乙炔和苯的混合物中含C—H键数目为0.6NA
B.10g46%的乙醇溶液中,含H—O键的数目为0.1NA
C.1L0.1mol·L1 FeCl3溶液中含Fe3+数目为0.1NA
D.将1molNH3通入足量水中,NH3 ·H2O、NH4+ 粒子数目之和为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25° C时,0.100 mol· L-1盐酸滴定25. 00 mL0. 1000 mol . L-1'氨水的滴定曲线如图所示。下列说法正确的是

A.滴定时,可迄用甲基橙或酚酞为指示剂
B.a、b两点水电离出的OH-浓度之比为10-4. 12
C.c点溶液中离子浓度大小顺序为c(Cl-) >c(NH4+)>c(H+ ) >c(OH-)
D.中和等体积等pH的氨水和NaOH溶液时消耗相同浓度盐酸的体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能应用化学平衡移动原理来解释的是
①可用浓氨水和NaOH固体快速制氨气 ②700K左右比室温更有利于合成氨反应
③开启啤酒瓶后,瓶中马上泛起大量泡沫 ④温度升高水的KW增大
⑤对于反应2HI(g) ![]() H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深
A. ①②③ B. ②④⑤ C. ②⑤ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,4.48L 空气中所含原子数为0.2NA
B.常温常压下,2.3g NO2和N2O4的混合物中含有的氧原子数为0.2NA
C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2 NA
D.常温下,0.1 mol·L-1Na2CO3溶液中阴离子总数大于0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随新能源汽车的发展,新能源电池技术也在不断创新,典型的锂离子电池一般以LiCoO2或LiFePO4等为正极材料,以石墨碳为负极材料,以溶有LiPF6等的有机溶液为电解质溶液。
(1)P原子的电子排布式为_________。Fe2+中未成对电子数为___________。
(2)N、O、F原子的第一电离能由小到大的顺序为_______。
(3)等电子体具有相似的化学键特征,它们的许多性质是相近的。ClO4-与PO43-互为等电子体,ClO4-的立体构型为_______,中心原子的杂化轨道类型为________。
(4)烷烃同系物中,CH4的沸点最低,原因是______________。
(5)向CuSO4溶液中加入氨水,首先形成蓝色沉淀,继续加氨水,沉淀溶解,得到深蓝色溶液,在此溶液中加入乙醇,析出深蓝色的晶体。由蓝色沉淀得到深蓝色溶液的离子方程式为_______________;深蓝色晶体中存在的化学键类型有__________ 。(填代号)
A.离子键
B.σ键
C.非极性共价键
D.配位键
E.金属键
F.氢键
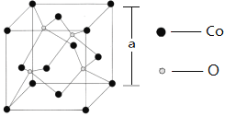
(6)如图所示为Co的某种氧化物的晶胞结构图,则该氧化物的化学式为______;若该晶胞的棱长为a pm,则该晶体的密度为_____________g/cm3。(NA为阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ 氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能够引起燃烧。某活动小组准备使用下列装置制备LiH固体。
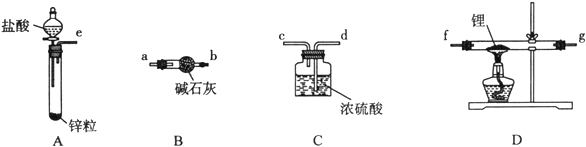
甲同学的实验方案如下:
(1)仪器的组装连接:上述仪器装置接口的连接顺序为____________________。
(2)添加药品:用镊子从试剂瓶中取出一定量金属锂(固体石蜡密封),然后在甲苯中浸洗数次,该操作的目的是_________,然后快速把锂放入到石英管中。
(3)加热一段时间后停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处。采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险。(反应方程式:LiH + H2O LiOH + H2↑),分析该反应原理,完成LiH与无水乙醇反应的化学方程式________。
(4)准确称量制得的产品0.174g,在一定条件下与足量水反应后,共收集到气体470.4 mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为____________________。
(5)乙同学对甲的实验方案提出质疑,他认为未反应的H2不能直接排放所以在最后连接了装置E用来收集H2,请将E装置补充完整___________________
测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:废水中氰化钠的最高排放标准为 0.50mg/L。Ag+ + 2CN- = [Ag(CN)2]-,Ag+ + I- = AgI↓,AgI呈黄色,且CN-优先于Ag+反应。
实验如下:取30.00 mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000×10-4 mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50 mL。滴定终点的判断方法是___________________________经计算处理后的废水中NaCN的浓度为_______________mg/L(保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的回收利用是环保和能源领域研究的热点课题,请根据要求回到下列问题:

(1)研究表明,利用太阳能可以将![]() 分解制收炭黑,其原理如图1所示,制取炭黑的化学反应方程式是______;
分解制收炭黑,其原理如图1所示,制取炭黑的化学反应方程式是______;
已知:①![]()
②![]()
则过程2 的热化学方程式为______。
(2)一定温度下,在密闭容器中进行反应![]() ,下列说法正确的是______
,下列说法正确的是______![]() 填字母序号
填字母序号![]()
A.当反应容器中压强不变时,反应达到平衡状态
B.升高温度,加快反应速率,![]() 的转化率增大
的转化率增大
C.增大![]() 的浓度,平衡向正反应方向移动,平衡常数增大
的浓度,平衡向正反应方向移动,平衡常数增大
D.平衡时CO、![]() 的体积分数一定相等
的体积分数一定相等
(3)在2L恒容密闭容器中充入![]() 和nmol
和nmol ![]() ,在一定条件下发生反应,
,在一定条件下发生反应,![]() ,
,![]() 的转化率与温度、投料比
的转化率与温度、投料比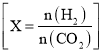 的关系如图2所示。
的关系如图2所示。
①该反应的平衡常数表达式为______,若![]() ,则B点的K______
,则B点的K______![]() 计算结果精确至
计算结果精确至![]() ;
;
②若在500K时,按![]() 投料,在恒压下进行,达到平衡状态,此时
投料,在恒压下进行,达到平衡状态,此时![]() 的转化率______
的转化率______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ;
;
(4)某研究团队设计出一种新型太阳能电池,能把大气中的二氧化碳转换成碳氢化合物燃料。如图3是通过
![]() 和
和![]() 作用制备
作用制备![]() 的原理示意图。b电极的电极反应为______。
的原理示意图。b电极的电极反应为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com