
已知可逆反应:A(g)+B(g)  C(g)+D(g) ΔH<0。请回答下列问题:
C(g)+D(g) ΔH<0。请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(A)=1 mol·L-1,c(B)=2.4 mol·L-1,达到平衡时,A的转化率为60%,此时B的转化率为________ _______________________________。
_______________________________。
(2)若反应温度降低,则B的转化率将________(填“增大”、“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(A)=4 mol·L-1,c(B)=a mol·L-1,达到平衡后c(C)=2 mol·L-1,则a=________。
(4)若反应温度不变,反应物的起始浓度分别为c(A)=c(B)=b mol·L-1,达到平衡后c(D)=________。(保留两位有效数字)
解析 (1)根据A的转化率可知,转化的A的浓度为0.6 mol·L-1,转化的B的浓度也为0.6 mol·L-1,B的转化率为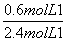 ×100%=25%。
×100%=25%。
(2)因为正反应为放热反应,所以降低温度,平衡向正反应方向移动,B的转化率增大。
(3)根据平衡时C的浓度可知,达到平衡时A、B、C、D的物质的量浓度分别为2 mol·L-1、(a-2) mol·L-1、2 mol·L-1、2 mol·L-1,根据(1)可知此温度下的平衡常数为K=(0.6×0.6)/(0.4×1.8)=0.5,所以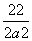 =0.5,解得a=6。
=0.5,解得a=6。
(4)设达到平衡后c(D)=x,则
A(g) + B(g)  C(g)+D(g)
C(g)+D(g)
起始(mol·L-1) b b 0 0
转化(mol·L-1) x x x x
平衡(mol·L-1) b-x b-x x x
则K=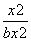 =0.5,解得x≈0.41b mol·L-1。
=0.5,解得x≈0.41b mol·L-1。
答案 (1)25% (2)增大 (3)6 (4)0.41b mol·L-1


科目:高中化学 来源: 题型:
斯坦福大学B.M. Trost教授提出了绿色化学的核心概念——原子经济性。我们常用原子利用率来衡量化学反应过程的原子经济性,其计算公式为:
原子利用率= ×100%
×100%
下面是新型自来水消毒剂ClO2的四种生产方法,请填空:
(1)氯酸钠和盐酸法:本方法的方程式为2NaClO3+4HCl===2NaCl+2ClO2↑+Cl2↑+2H2O,此方法的原子利用率为________%(保留一位小数,下同)。
(2)电解亚氯酸钠法:本方法是用惰性电极电解亚氯酸钠溶液,原子利用率为62.2%,其阳极电极反应式为:ClO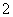 -e-===ClO2,阴极电极反应式为_______________。
-e-===ClO2,阴极电极反应式为_______________。
(3)亚氯酸钠和氯气法:本方法的原子利用率为53.6%,此反应的化学方程式为____________________________________。
(4)联合工艺法:本方法的反应原理由三步组成:
①电解氯化钠溶液NaCl+3H2O NaClO3+3H2↑
NaClO3+3H2↑
②氢气和氯气合成氯化氢
③生成二氧化氯2NaClO3+4HCl===2NaCl+2ClO2↑+Cl2↑+2H2O此方法的原子利用率最大为________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对熵的理解不正确的是
A.同种物质气态时熵值最大,固态时熵值最小
B.体系越有序,熵值越小;越混乱,熵值越大
C.与外界隔离的体系,自发过程将导致体系的熵减小
D.25 ℃、1.01×105 Pa时,2N2O5(g)===4NO2(g)+O2(g)是熵增的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)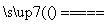 2CO2(g)+S(l) ΔH<0。若反应在恒容的密闭容器中进行,下列有关说法正确的是
2CO2(g)+S(l) ΔH<0。若反应在恒容的密闭容器中进行,下列有关说法正确的是
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应的平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
NO2可用氨水吸收生成NH4NO3。25 ℃时,将a mol NH4NO3溶于水,溶液显酸性,原因是_______________________________________________________________
(用离子方程式表示)。向该溶液滴加b L氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将________(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为________________________________________________________________________
mol·L-1。(NH3· H2O的电离平
H2O的电离平 衡常数取Kb=2×10-5 mol·L-1)
衡常数取Kb=2×10-5 mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
①加少量烧碱 ②升高温度 ③加少量冰醋酸 ④加水
A.①② B.②④
C.②③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验原理或实验操作正确的是( )
A.用水润湿的 pH 试纸测量某溶液的 pH
B.用量筒量取 20 mL 0.500 0 mol·L-1H2SO4 溶液于烧杯中,加水 80 mL,配制成 0.100 0 mol·L-1H2SO4 溶液
0.100 0 mol·L-1H2SO4 溶液
C.实验室用图1所示装置制取少量氨气
D.实验室用图2所示装置除去 Cl2 中的少量 HCl

查看答案和解析>>
科目:高中化学 来源: 题型:
已知:pOH=-lg c(OH-),在常温下溶液中的pH+pOH=14,又已知正常人(人的体温高于室温)的血液pH=7.3,则正常人血液的pOH是
A.大于6.7 B.小于6.7
C.等于6.7 D.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com