
����Ŀ��ͼʾ����ͼ���dz��õĿ�ѧ�о�������
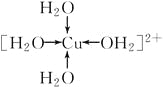
(1)��ѧ��ͨ��X�����Ʋ���мȺ�����λ���ֺ����������ṹʾ��ͼ�ɼ�ʾ���£�������λ����������������߱�ʾ��

��д����̬Cuԭ�ӵĺ�������Ų�ʽ________________________________��
��д������������ˮ��ͭ���ӵĽṹ��ʽ(���뽫��λ����ʾ����)________��
(2)��ͼ���о�����Ԫ���⻯��ķе�仯���ɵ�ͼ������c���Ա������________��Ԫ���⻯��ķе�仯���ɡ���λͬѧ��ij����Ԫ���⻯��ķе�ı仯���ƻ���������������������a������b������Ϊ��ȷ����________(����a������b��)��������______________________________________________________________��

(3)��������Ԫ�ص���̬�����Ի�̬ԭ��ʧȥ�����һ������ת��Ϊ��̬��̬������������������������һ������(��ΪE)����ͼ��ʾ��

��ͬ�����ڣ�����ԭ������������Eֵ�仯����������________��
������ͼ���ṩ����Ϣ�����ƶ�E��________E��(����>������<��������������ͬ)��
�����ݵ�һ�����ܵĺ����Ԫ�������ɣ����ƶ�Eþ________E����
���𰸡�(1)��1s22s22p63s23p63d104s1��[Ar]3d104s1
��
(2)��A��b��A���ʾ���⻯����ˮ����е����������ˮ����֮���������������ǿ��Զ���ڷ��»�������������Ԫ���������⻯��ķе㲻�����ˮ
(3)��������<����>
��������
���������д���������[Cu��H2O��4]2����H2O�е�Oԭ���ṩ�µ��Ӷԣ�Cu2���ṩ�չ���γ���λ�����Ӷ�����д��ˮ��ͭ���ӵĽṹ��ʽ����2����ͼʾ�⻯��ķе�仯���ɿ�����c���⻯��е������ߣ�˵��û�������Ӱ�죬Ӧ�ǵ���A��Ԫ�ء�����a��b��˵���⻯���к���������ڶ������⻯��ķе�Ϊ100 ����ӦΪ����A��Ԫ�أ���a�ߵı仯���Ʋ��ԣ�b��ȷ����3��ͬ�����ڣ�����ԭ������������һ��������������������ͬ�����ڣ����ŵ��Ӳ��������࣬��һ����������������С��


 һ��һ����ʱ���ϵ�д�
һ��һ����ʱ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ����Ȼ���г��Զ�����̬���ڣ����Կ�ȸʯ��ʯ[�ɷ�ΪCu2(OH)2CO3��CuFeS2��SiO2��Fe2O3��]Ϊԭ����������Ʒ��������Ʒ����Ĺ���������ͼ��
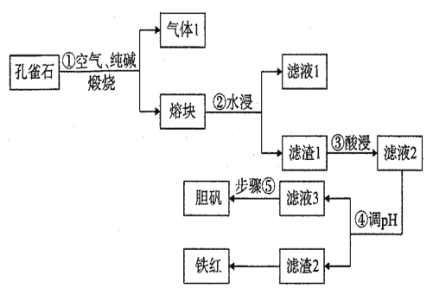
��1������1�ijɷֳ�H2O��g���⣬����CO2��SO2��д��������з���������ԭ��Ӧ�Ļ�ѧ����ʽΪ _______________������Ӧ����1mol SO2����Ӧ��ת�Ƶĵ�����Ϊ___________mol����Һ1����Ҫ�ɷ�Ϊ__________��д��ѧʽ��
��2��Ŀǰ��ҵ�����в��������İٷ���Ϊ70%��Ϊ��һ���������İٷ��ʿɲ�ȡ�Ĵ�ʩ��_________________��������㣩��
��3������ܵ�pH�����Լ�Ϊ_____________ ��д��ѧʽ��
��4����������Һ3��pH=4��Ksp[Fe(OH) 3]=4��10-38������Һ3��c��Fe3+��=___________��
��5������ݲ���Ϊ_______________________________________________________.��
��6������ʹ�ÿ�ȸʯ��ʯ����Ϊm kg�����������İٷ���Ϊ70%��������2�������������Ϊn kg����
���������;֮һΪ________��
�ڿ�ȸʯ��ʯ����Ԫ�صĺ���Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ơ��⡢���ʯ���ɱ����Ȼ��ƾ���ľ���ͼ(δ��˳������)��
(1)���(������Ӧ�ı����д)��
���ƾ�����________��
�ڵ⾧����________��
�۽��ʯ������________��
�ܸɱ�������________��
���Ȼ��ƾ�����________��
(2)����ľ���������ͬ����__________��
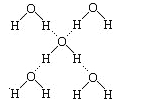
(3)�ڱ������У�ÿ��ˮ���������ڵ�4��ˮ�����γ����(��ͼ��ʾ)����֪������������51 kJ��mol��1��������⣬ˮ���Ӽ仹���ڷ��»���(11 kJ��mol��1)���������������ġ����ܡ���________kJ��mol��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС����˽̰�̲�ʵ�顰��200mL�ձ��з���20g���ǣ�C12H22O11������������ˮ��������ȣ�Ȼ���ټ���15mL��������Ϊ98%Ũ���ᣬѸ�ٽ��衱��������̽����
��1���۲����������ȱ�ƣ�����ڣ�������ͣ��γ����ɶ�ĺ���״��ɫ���ʣ�ͬʱ�ŵ��̼�����ζ����ѹ�˺�ɫ����ʱ���о���Ӳ������ˮ�г�Ư��״̬��ͬѧ�������������Ʋ�����н��ۣ�
��Ũ�������ǿ������ ��Ũ���������ˮ�� ��Ũ���������ˮ�Ԣ�Ũ����������� �ݺ�ɫ���ʾ���ǿ������
�������ݲ���ֵ���_________������ţ���
��2��Ϊ����֤������Ũ���ᷴӦ���ɵ���̬���ͬѧ�����������װ�ã�
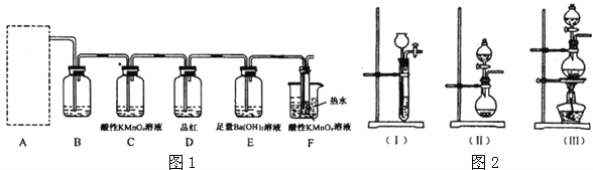
�Իش��������⣺
��ͼ1��A�����ѡ������װ��_________�����ţ���
��ͼ1�� Bװ����װ�Լ���_________��Dװ�����Լ���������_________��Eװ���з�����������_________��
��ͼ1��Aװ����ʹ�����ȱ�ڵĻ�ѧ��Ӧ����ʽΪ_________����������͵Ļ�ѧ����ʽΪ��_________��
��ijѧ����ͼ2����ʵ��ʱ������DƿƷ�첻��ɫ��Eװ�����������ݳ���Fװ�������Ը��������Һ��ɫ��dz���Ʋ�Fװ�������Ը��������Һ��ɫ��dz��ԭ��_________���䷴Ӧ�����ӷ���ʽ��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cu2+����NH3��H2O��OH����Cl�����γ���λ��Ϊ4������
��1����CuSO4��Һ�м������NaOH��Һ������Na2[Cu��OH��4]��
�ٻ���������[Cu��OH��4]2+�е���λ��__��
��Na2[Cu��OH��4]�г�����λ���⣬�����ڵĻ�ѧ��������__������ţ���
A�����Ӽ� B�������� C�����Թ��ۼ� D���Ǽ��Թ��ۼ�
��2������ͭ�����백ˮ��������ⶼ���ܷ�Ӧ�������백ˮ��������Ļ����Һ�������·�Ӧ��Cu+H2O2+4NH3�T[Cu��OH��4]2++2OH������ԭ����_________________��
��3��Cu2+�������Ҷ�����H2N��CH2CH2��NH2���γ������ӣ���ͼ����

��H��O��N����Ԫ�صĵ縺�ԴӴ�С��˳��____��
���Ҷ���������Nԭ�ӳɼ�ʱ��ȡ���ӻ�������__��
���Ҷ����е����Cl��CH2CH2��Cl����Ҫԭ����__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������·�ӦmA(g)+nB(g)![]() pC(g)+qD(g)��һ�ܱ������н��У����ƽ����Ӧ�ٶ�v(C)=2v(B)������Ӧ��ƽ����¶Ȳ��䣬�Ӵ���ϵѹǿʱƽ�ⲻ�ƶ�����m��n��p��q����ֵ�����ǣ� ��
pC(g)+qD(g)��һ�ܱ������н��У����ƽ����Ӧ�ٶ�v(C)=2v(B)������Ӧ��ƽ����¶Ȳ��䣬�Ӵ���ϵѹǿʱƽ�ⲻ�ƶ�����m��n��p��q����ֵ�����ǣ� ��
A.2��6��3��5B.3��1��2��2
C.3��1��2��1D.1��3��2��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(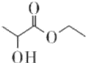 )��һ��ʳ�����ϣ������ڵ��ƹ����͡�������ʳ�ú;��þ�������������ͬ���칹��M���������ʣ�0.1mol M�ֱ��������Ľ����ƺ�̼�����Ʒ�Ӧ����������������ͬ״���µ������ͬ����M�Ľṹ�����(�����ǿռ��칹)
)��һ��ʳ�����ϣ������ڵ��ƹ����͡�������ʳ�ú;��þ�������������ͬ���칹��M���������ʣ�0.1mol M�ֱ��������Ľ����ƺ�̼�����Ʒ�Ӧ����������������ͬ״���µ������ͬ����M�Ľṹ�����(�����ǿռ��칹)
A. 8��B. 9��C. 10��D. 12��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС�����ʵ��̽��SO2��Ư�۾���Ӧԭ����װ����ͼ��ʾ����
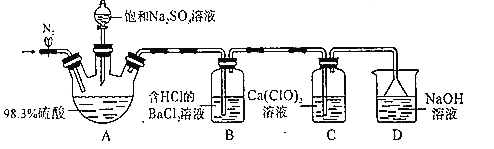
ʵ������������£�
����1������װ�ò����װ�������ԣ�����ͼ��ʾװ��ҩƷ��
����2����ֹˮ�У���װ����ͨ��һ��ʱ��N2�����ر�ֹˮ�У�
����3��ȡ�·�Һ©�������ӣ���ת������������ƿ�еμӱ���Na2SO3��Һ����һ������۲쵽B��C�ж�������ɫ����
����4��ʵ����Ϻ���C�а�ɫ���壬��ɫ������CaSO4��
�ش��������⣺
��1��Bװ���������������__����֤��A�в�����������������H2SO4��ʵ��������___��
��2��A��������ֳ�����������__��
��3������2��ͨ��N2��Ŀ����__��
��4��ʵ����Ϻ����飬D����Һ���е����ʵ���Ũ�ȵ����ֻ�ԭ���Σ�д���ܷ�Ӧ�����ӷ���ʽ__��
��5������4����C�а�ɫ�����ɷֵIJ����ǣ�ȡ����C�а�ɫ���壬�μ�����___�������ƣ�������ɫ���岻�ܽ⣬���ɫ������CaSO4��
��6����������C�з�����ѧ��Ӧ�뷴Ӧ��������йأ�
��ͨ������SO2��������ӦΪ3Ca(ClO)2+2SO2+2H2O�T2CaSO4��+4HClO+CaCl2��
��ͨ�����SO2��������ӦΪCa(ClO)2+2SO2+2H2O�TCaSO4��+H2SO4+2HCl��SO2+H2OH2SO3��
���ʵ��֤������C��ͨ�����SO2��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
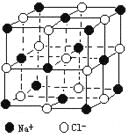
����Ŀ��������й���ļ������Σ���������������ظ���Ԫ��֮Ϊ������NaCl����ľ�������ͼ��ʾ�� ���ſ�ѧ�����ķ�չ���ⶨ�����ӵ��������ֶ�Խ��Խ�࣬�ⶨ��ȷ��ҲԽ��Խ�ߡ�����һ���еIJⶨ���������岽�����£���������ʳ����ϸ�������ȷ��ȡm gNaCl���岢ת�Ƶ���������A�С����õζ���������A�мӱ����������������ӱ���A�����Ŀ̶��ߣ������NaCl��������ΪVmL���ش��������⣺
����������A���������__________________(����������)��
���ܷ��ý�ͷ�ιܴ��沽�����еĵζ���______����ԭ����____________��
���ܷ���ˮ���汽_______����ԭ����______________________��
����X����������NaCl���������ڽ���Na+ ��Cl- ƽ������Ϊacm������������
������õİ����ӵ������ı���ʽΪNA=_______________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com