
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
选项 | A | B | C | D |
实验 | 用CCl4提取溴水中的Br2 | 从食盐水中提取NaCl固体 | 从KI和I2的固体混合物中回收I2 | 配制100 mL0.1000 mol·L-1Na2CO3溶液 |
装置或仪器 |
|
|
|
|
A.AB.BC.CD.D
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
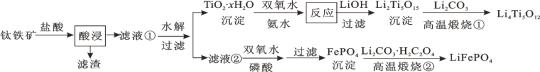
下列说法不正确的是
A.“酸浸”后,若钛主要以TiOCl42-形式存在,则相应反应的离子方程式可表示为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
B.若Li2Ti5O15中Ti的化合价为+4,则其中过氧键的数目为3个
C.“高温煅烧②”中由FePO4制备LiFePO4的化学方程式可表示为:2FePO4+Li2CO3+H2C2O4![]() 2LiFeO4+H2O↑+3CO2↑
2LiFeO4+H2O↑+3CO2↑
D.TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
可知,40℃前,未达到平衡状态,随着温度升高,转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求计算。
(1)0.5mol NaAlO2含有___mol Na+;_____mol AlO2-;含___个O。
(2)在100 mL 0.2 mol/L NaOH溶液中含溶质的物质的量___mol;配制50 mL 0.2 mol/LFeSO4溶液,需要FeSO4____ g。
(3)1.06 g的Na2CO3的物质的量是___mol;含有的CO32-离子数是___个。
(4)标准状况下,0.3 mol CH4的体积是___;含有碳原子质量是___;含有氢原子物质的量_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空:
(1)由CH4和O2组成的混合气体在标准状况下的密度为l g·L-1,则该混合气体中CH4和O2的体积比为________。
(2)用98%(密度为1.84g/mL )的浓硫酸配制500mL 2.5mol/L的稀硫酸,需用量筒量取浓硫酸的体积为________mL。
(3)向100mL 0.2mol/L 的NaAlO2溶液与300mL 0.1mol/L的HCl溶液混合,反应的离子方程式: _________________。
(4)某混合溶液中仅含有离子:Fe2+、Cl-、Br-、I-,测得Cl-、Br-、I-的物质的量之比为2:3:4,往溶液中通入一定量的氯气,充分反应后溶液中Cl-和Br-的物质的量之比为3:1,则通入的氯气的物质的量与溶液中剩余Fe2+的物质的量之比为=_________________。(假设溶液的体积在反应前后不变)
(5)酸性条件下,向FeI2的淀粉溶液中加入H2O2溶液后变蓝。当有1mol Fe2+被氧化成Fe3+时,转移电子4mol。写出该反应的离子方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,恒容密闭容器中发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O)(g),下列叙述不能说明该反应达平衡的是( )
4NO(g)+6H2O)(g),下列叙述不能说明该反应达平衡的是( )
A.V(正)(O2)=![]() V(逆)(NO)B.密闭容器内气体的密度不再改变
V(逆)(NO)B.密闭容器内气体的密度不再改变
C.密闭容器的压强不变D.氮气的浓度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体化合物X由四种常见的元素组成,为探究其成分,某学生进行如下实验:
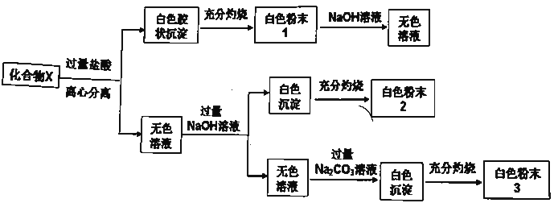
①20.8gX固体进行实验,得到白色粉末1质量12.0g,白色粉末2质量为6.0g;
②白色粉末2可用作耐高温材料,白色粉末3是一种常见干燥剂;请回答问题:
(1)X中金属元素的名称是______。
(2)化合物X与足量盐酸反应离子方程式______。
(3)在高温条件下,白色粉末2中某元素单质与白色粉末1反应,是工业制备另一种单质方法之一,写出该反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水煤气,化学反应方程式为___。
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
①合成氨的反应中的能量变化如图所示。该反应是___反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量___(填“大于”或“小于”)生成物化学键形成放出的总能量。

②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是____(填序号)。
A.容器中N2、H2、NH3共存 B.N2、NH3浓度相等
C.N2、H2、NH3的物质的量之比为1:3:2 D.容器中的压强不随时间变化
(3)工业上用电解饱和食盐水的方法制取氯气、烧碱和氢气。其化学反应方程式为____。用氯气和烧碱可进一步反应,制得消毒液,反应的离子方程式为___。
(4)如图是某笔记本电脑使用的甲醇空气燃料电池的结构示意图。放电时甲醇应从__处通入(填“a”或“b”),电池内部H+向__(填“左”或“右”)移动,写出负极的电极反应式__。
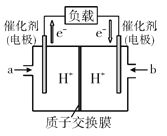
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:
mCeO2![]() (m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2
(m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2![]() mCeO2+ xH2+ xCO
mCeO2+ xH2+ xCO
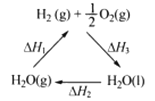
下列说法不正确的是
A. 该过程中CeO2没有消耗
B. 该过程实现了太阳能向化学能的转化
C. 右图中△H1=△H2+△H3
D. 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—=CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌与浓硫酸反应,随着硫酸的浓度下降,产生的气体中混有H2,为证实相关分析,化学小组的同学设计了如图所示的实验装置,对反应后的气体(X)取样进行组分分析(遇有气体吸收过程,视为完全吸收)。
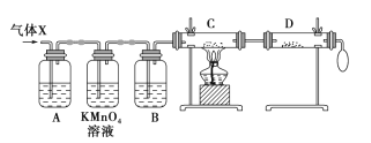
(1)A中加入的试剂可能是_________,若高锰酸钾溶液与B 之间不再添加装置,请描述观察到何种现象能表明已达到使用高锰酸钾溶液的目的_______________。
(2)可证实气体 X 中混有较多氢气的实验现象是___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com