
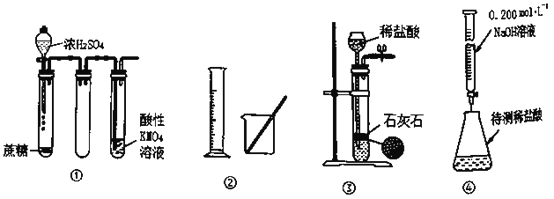
°ĺŐ‚ńŅ°Ņįī“™«ůÕÍ≥…Ō¬Ń–ŐÓŅ’:
£®1£©”…CH4ļÕO2◊ť≥…ĶńĽžļŌ∆ÝŐŚ‘ŕĪÍ◊ľ◊īŅŲŌ¬Ķń√‹∂»ő™l g°§L-1£¨‘Úł√ĽžļŌ∆ÝŐŚ÷–CH4ļÕO2ĶńŐŚĽżĪ»ő™________°£
£®2£©”√98%(√‹∂»ő™1.84g/mL )ĶńŇ®ŃÚňŠŇš÷∆500mL 2.5mol/LĶńŌ°ŃÚňŠ£¨–Ť”√ŃŅÕ≤ŃŅ»°Ň®ŃÚňŠĶńŐŚĽżő™________mL°£
£®3£©ŌÚ100mL 0.2mol/L ĶńNaAlO2»‹“ļ”Ž300mL 0.1mol/LĶńHCl»‹“ļĽžļŌ£¨∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺ£ļ _________________°£
£®4£©ń≥ĽžļŌ»‹“ļ÷–ĹŲļ¨”–ņŽ◊”£ļFe2+°ĘCl-°ĘBr-°ĘI-£¨≤‚Ķ√Cl-°ĘBr-°ĘI-ĶńőÔ÷ ĶńŃŅ÷ģĪ»ő™2£ļ3£ļ4£¨Õý»‹“ļ÷–Õ®»Ž“Ľ∂®ŃŅĶń¬»∆Ý£¨≥š∑÷∑ī”¶ļů»‹“ļ÷–Cl-ļÕBr-ĶńőÔ÷ ĶńŃŅ÷ģĪ»ő™3£ļ1£¨‘ÚÕ®»ŽĶń¬»∆ÝĶńőÔ÷ ĶńŃŅ”Ž»‹“ļ÷– £”ŗFe2+ĶńőÔ÷ ĶńŃŅ÷ģĪ»ő™=_________________°££®ľŔ…Ť»‹“ļĶńŐŚĽż‘ŕ∑ī”¶«įļů≤ĽĪš£©
£®5£©ňŠ–‘ŐűľĢŌ¬£¨ŌÚFeI2ĶńĶŪ∑Ř»‹“ļ÷–ľ”»ŽH2O2»‹“ļļůĪšņ∂°£ĶĪ”–1mol Fe2+ĪĽ—űĽĮ≥…Fe3+ Ī£¨◊™“∆ĶÁ◊”4mol°£–ī≥Ųł√∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺ£ļ_________°£
°ĺīūįł°Ņ3°√2 67.9 6AlO2-+9H++3H2O=5Al(OH)3°ż+Al3+ 7£ļ3 2Fe2++6I-+4H2O2+8H+=2Fe3++3I2+8H2O
°ĺĹ‚őŲ°Ņ
£®1£©Ņ…ņŻ”√°į ģ◊÷ĹĽ≤ś∑®°Īņīľ∆ň„£Ľ
£®2£©ņŻ”√Ō° Õ∂®¬…ľ∆ň„ľīŅ…£Ľ
£®3£©łýĺ›∑ī”¶őÔĶńőÔ÷ ĶńŃŅ£¨Ņ…“‘Ō»Ň–∂Ō≥ŲĻżŃŅĶńő Ő‚£¨‘Ŕłýĺ› £”ŗĶńŃŅ»•∑÷őŲļů–Ý∑ī”¶Ķń«ťŅŲ£¨◊ÓļůĹęŃĹłŲĽĮ—ß∑Ĺ≥Ő ĹŌŗľ”£¨‘ŔĹęŌĶ żĽĮ’ŻľīŅ…£Ľ
£®4£©ĽĻ‘≠–‘£ļI->Fe2+>Br-£¨Ő‚÷–łś÷™”–Fe2+ £”ŗ£¨‘ÚňĶ√ųCl2≤Ęőī”ŽBr-∑ī”¶£¨”…īňĹÝ––ľ∆ň„£Ľ
£®5£©Ō»–ī≥ŲFe2+ļÕI-∑÷Īū”ŽH2O2Ķń∑ī”¶∑Ĺ≥Ő Ĺ£¨‘Ŕłýĺ›ĶÁ◊”◊™“∆ żńŅ∑÷őŲŃĹłŲ∑ī”¶ĶńŌŗĻōőÔ÷ ĶńŃŅ£¨ī”∂ÝĽŮĶ√◊‹Ķń∑ī”¶∑Ĺ≥Ő Ĺ°£
£®1£©‘ŕĪÍŅŲŌ¬£¨¶—(CH4)=![]() g°§L-1£¨¶—(O2)=
g°§L-1£¨¶—(O2)=![]() g°§L-1£¨łýĺ› ģ◊÷ĹĽ≤ś∑®£ļ
g°§L-1£¨łýĺ› ģ◊÷ĹĽ≤ś∑®£ļ
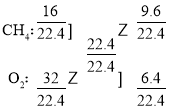 £¨‘Ún(CH4)£ļn(O2)=3£ļ2£¨ľīV(CH4)£ļV(O2)=3£ļ2£Ľ
£¨‘Ún(CH4)£ļn(O2)=3£ļ2£¨ľīV(CH4)£ļV(O2)=3£ļ2£Ľ
£®2£©…Ť–Ť“™Ň®ŃÚňŠV mL£¨‘Ú”–£ļ![]() £¨Ĺ‚Ķ√V=67.9mL£Ľ
£¨Ĺ‚Ķ√V=67.9mL£Ľ
£®3£©n(NaAlO2)=0.1L°Ń0.2mol/L=0.02mol£¨n(HCl)= 0.3L°Ń0.1mol/L=0.03mol£¨‘Ú‘ŕ∑ī”¶H++AlO2-+H2O=Al(OH)3°ż÷–£¨H+ĻżŃŅ£Ľ‘ŕ∑ī”¶4H++ AlO2-=Al3++2H2O÷–£¨AlO2-ĻżŃŅ£Ľňý“‘Ņ…“‘Õ∆∂Ō≥Ų∑Ę…ķ∑ī”¶£ļH++AlO2-+H2O=Al(OH)3°ż£¨ĻżŃŅĶńH+‘ŔļÕAl(OH)3∑ī”¶£ļ3H++ Al(OH)3=Al3++3H2O£Ľ‘ŕĶŕ“ĽłŲ∑ī”¶÷–£¨ŌŻļń0.02mol H+£¨…ķ≥… 0.02mol Al(OH)3£¨ £”ŗ0.01 mol H+£¨ľī0.02H++0.02AlO2-+0.02H2O=0.02Al(OH)3°ż£¨‘ŕĶŕ∂ĢłŲ∑ī”¶÷–£¨0.01mol H+ÕÍ»ę≤őľ”∑ī”¶£¨ŌŻļń![]() mol Al(OH)3£¨…ķ≥…
mol Al(OH)3£¨…ķ≥…![]() mol AlO2-£¨ľī0.01H++
mol AlO2-£¨ľī0.01H++![]() Al(OH)3=
Al(OH)3=![]() Al3++0.01H2O£¨ĹęŃĹłŲ∑Ĺ≥Ő ĹŌŗľ”Ņ…Ķ√£ļ 0.02AlO2-+0.03H++0.01H2O=
Al3++0.01H2O£¨ĹęŃĹłŲ∑Ĺ≥Ő ĹŌŗľ”Ņ…Ķ√£ļ 0.02AlO2-+0.03H++0.01H2O=![]() Al(OH)3°ż+
Al(OH)3°ż+![]() Al3+£¨ŌĶ żĽĮ’ŻĶ√£ļ6AlO2-+9H++3H2O=5Al(OH)3°ż+Al3+£Ľ
Al3+£¨ŌĶ żĽĮ’ŻĶ√£ļ6AlO2-+9H++3H2O=5Al(OH)3°ż+Al3+£Ľ
£®4£©…ŤCl-°ĘBr-°ĘI-ĶńőÔ÷ ĶńŃŅ“ņīőő™2mol°Ę3mol°Ę4mol£¨‘ÚFe2+ĶńőÔ÷ ĶńŃŅő™![]() mol£Ľ“Úő™ĽĻ‘≠–‘£ļI->Fe2+>Br-£¨ňý“‘I-Ō»ļÕCl2
mol£Ľ“Úő™ĽĻ‘≠–‘£ļI->Fe2+>Br-£¨ňý“‘I-Ō»ļÕCl2
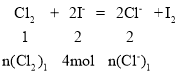 £¨‘Ún(Cl2)1=2mol£¨n(Cl-)1=4mol£Ľ
£¨‘Ún(Cl2)1=2mol£¨n(Cl-)1=4mol£Ľ
…ŤļÕFe2+∑ī”¶ĶńőÔ÷ ĶńŃŅő™x mol£¨
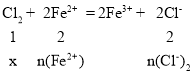 £¨n(Cl-)2=2x mol£¨n(Fe2+)=2x mol£Ľ
£¨n(Cl-)2=2x mol£¨n(Fe2+)=2x mol£Ľ
‘Ú∑ī”¶ļů£¨»‹“ļ÷–Cl-ĶńőÔ÷ ĶńŃŅő™(2+4+2x)mol£¨“Úő™∑ī”¶ļůCl-ļÕBr-ĶńőÔ÷ ĶńŃŅĪ»ő™3£ļ1£¨ňý“‘”–£ļ![]() £¨Ĺ‚Ķ√x=
£¨Ĺ‚Ķ√x=![]() £¨Õ®»ŽĶńCl2ĶńőÔ÷ ĶńŃŅő™(2+x)=
£¨Õ®»ŽĶńCl2ĶńőÔ÷ ĶńŃŅő™(2+x)=![]() mol£¨»‹“ļ÷– £”ŗFe2+ĶńőÔ÷ ĶńŃŅő™(
mol£¨»‹“ļ÷– £”ŗFe2+ĶńőÔ÷ ĶńŃŅő™(![]() )mol=
)mol=![]() mol£¨ňý“‘Õ®»ŽĶń¬»∆ÝĶńőÔ÷ ĶńŃŅ”Ž»‹“ļ÷– £”ŗFe2+ĶńőÔ÷ ĶńŃŅ÷ģĪ»ő™7£ļ3£Ľ
mol£¨ňý“‘Õ®»ŽĶń¬»∆ÝĶńőÔ÷ ĶńŃŅ”Ž»‹“ļ÷– £”ŗFe2+ĶńőÔ÷ ĶńŃŅ÷ģĪ»ő™7£ļ3£Ľ
£®5£©ł√Ļż≥Ő…śľįŃĹłŲ∑ī”¶£ļH2O2+2H++2Fe2+=2Fe3++2H2OļÕ2H++H2O2+2I-=I2+2H2O£¨’‚ŃĹłŲ∑ī”¶ Ĺ÷–ĺý◊™“∆2e-£Ľ”–1mol Fe2+ĪĽ—űĽĮ≥…Fe3+ Ī£¨◊™“∆ĶÁ◊”4mol£¨‘Ú”–2mol Fe2+ĪĽ—űĽĮ≥…Fe3+ Ī£¨◊™“∆ĶÁ◊”8mol£¨∂Ý2mol Fe2+◊‘…Ū ß»•2mol e-£¨ňý“‘”–6mol e-”…6mol I- ß»•£¨ľī∑Ę…ķ∑ī”¶£ļH2O2+2H++2Fe2+=2Fe3++2H2OļÕ6H++3H2O2+6I-=3I2+6H2O£¨ĹęŃĹłŲ∑Ĺ≥ŐŌŗľ”Ņ…Ķ√£ļ2Fe2++6I-+4H2O2+8H+=2Fe3++3I2+8H2O°£


 ń‹Ņľ ‘∆ŕń©≥ŚīŐĺŪŌĶŃ–īūįł
ń‹Ņľ ‘∆ŕń©≥ŚīŐĺŪŌĶŃ–īūįł
| ńÍľ∂ | łŖ÷–Ņő≥Ő | ńÍľ∂ | ≥ű÷–Ņő≥Ő |
| łŖ“Ľ | łŖ“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű“Ľ | ≥ű“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ∂Ģ | łŖ∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű∂Ģ | ≥ű∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ»ż | łŖ»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű»ż | ≥ű»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° |
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ»ÁÕľ «NO2ļÕO2–ő≥…Ķń‘≠ĶÁ≥ō◊į÷√°£Ō¬Ń–ňĶ∑®≤Ľ’ż»∑Ķń «
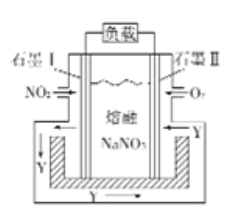
A. ĮńęĘÚ◊Ų’żľę,O2∑Ę…ķĽĻ‘≠∑ī”¶
B. ł√ĶÁ≥ō∑ŇĶÁ ĪNO3-ī””“≤ŗŌÚ◊ů≤ŗ«®“∆
C. ĶĪŌŻļń1mol NO2 Ī£¨ĶÁĹ‚÷ ÷–◊™“∆1mol e
D. ĮńęĘŮłĹĹŁ∑Ę…ķĶń∑ī”¶ő™NO2+NO3--e-=N2O5
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŌ¬Ń–∑ī”¶ Ű”ŕ—űĽĮĽĻ‘≠∑ī”¶Ķń «
A. CaCO3+2HCl=CaCl2+CO2°Ł+ H2O
B. CaO+H2O=Ca£®OH£©2
C. 2H2O2![]() 2H2O+O2°Ł
2H2O+O2°Ł
D. CaCO3![]() CaO+CO2°Ł
CaO+CO2°Ł
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŌ¬Ń–”–Ļō Ķ—ť◊į÷√ĶńňĶ∑®≤Ľ’ż»∑Ķń «
A.◊į÷√ĘŔ÷–ňŠ–‘łŖ√ŐňŠľō»‹“ļ÷–≥ŲŌ÷∆ÝŇ›£¨«“—’…ę÷ūĹ•Õ »•
B.ņŻ”√Ęŕ÷–“«∆ųŅ…“‘Ňš÷√75%Ķńĺ∆ĺ껋“ļ
C.◊į÷√ĘŘŅ…”√”ŕ Ķ—ť “÷∆ĪłCO2∆ÝŐŚ
D.◊į÷√Ę‹Ņ…”√ņī≤‚∂®őī÷™Ň®∂»ĶńŌ°—őňŠ
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ2019ńÍ «‘™ňō÷‹∆ŕĪŪĶģ…ķ150÷‹ńÍ£¨ńŅ«į÷‹∆ŕĪŪ∆ŖłŲ÷‹∆ŕĺý“—ŇҬķ£¨Ļ≤118÷÷‘™ňō£¨»ÁÕľ «‘™ňō÷‹∆ŕĪŪ∂Ő÷‹∆ŕĶń“Ľ≤Ņ∑÷£¨Ō¬Ń–ňĶ∑®÷–’ż»∑Ķń «£® £©
A. ‘™ňōĘŔőĽ”ŕĶŕ∂Ģ÷‹∆ŕĶŕĘŰA◊Ś
B. ∆ÝŐ¨«‚ĽĮőÔĶńő»∂®–‘£ļĘ‹>Ęŕ
C. ◊ÓłŖľŘ—űĽĮőÔ∂‘”¶ňģĽĮőÔĶńňŠ–‘£ļĘ›>Ę‹
D. ‘™ňōĶń◊ÓłŖ’żĽĮļŌľŘ£ļĘŘ£ĹĘ›
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅM»‹“ļ ‹»»ĽŠ∑Ę…ķ∑÷Ĺ‚∑ī”¶°£ŐŚĽżĺýő™2LĶń4◊ť»‹“ļ(ļŲ¬‘∑ī”¶«įļůŐŚĽżĶńĪšĽĮ)£¨MĶńőÔ÷ ĶńŃŅňś ĪľšĶńĪšĽĮ»ÁŌ¬ĪŪ£¨‘ÚŌ¬Ń–ňĶ∑®≤Ľ’ż»∑Ķń «
0min | 10min | 20min | 30min | 40min | 50min | 60min | ||
ĘŔ | 10°ś | 1.1 | 0.90 | 0.80 | 0.73 | 0.68 | 0.65 | 0.65 |
Ęŕ | 10°ś | a | 0.70 | 0.65 | 0.65 | 0.65 | 0.65 | 0.65 |
ĘŘ | 25°ś | 1.0 | 0.70 | 0.50 | 0.35 | 0.25 | 0.20 | 0.20 |
Ę‹ | 30°ś | 2.0 | 1.4 | 0.90 | 0.50 | 0.20 | 0.13 | 0.13 |
A.‘ŕ10-20minńŕ£¨ Ķ—ťĘŔ÷–MĶń∆Ĺĺý∑÷Ĺ‚ňŔ¬ ő™0.005mol/(L°§min)
B.a>1.1£¨«“ňĶ√ųŇ®∂»‘Ĺīů∑ī”¶ňŔ¬ ‘ĹŅž
C.∂‘Ī» Ķ—ťĘŔļÕĘ‹£¨≤Ľń‹ňĶ√ųMĶń∆Ĺĺý∑ī”¶ňŔ¬ ňśő¬∂»…żłŖ∂Ý‘Ųīů
D.≤ĽŅľ¬«∆šňŁ”įŌž“Úňō£¨ĹŲ”…ĘŘŅ…÷™£¨∑ī”¶őÔŇ®∂»‘Ĺīů∑ī”¶ňŔ¬ ‘ĹŅž
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅÕÍ≥…Ō¬Ń– Ķ—ťňý—°‘ŮĶń◊į÷√ĽÚ“«∆ų£®ľ–≥÷◊į÷√“—¬‘»•£©’ż»∑Ķń «£®°°°°£©
—°ŌÓ | A | B | C | D |
Ķ—ť | ”√CCl4ŐŠ»°šŚňģ÷–ĶńBr2 | ī” ≥—őňģ÷–ŐŠ»°NaClĻŐŐŚ | ī”KIļÕI2ĶńĻŐŐŚĽžļŌőÔ÷–Ľō ’I2 | Ňš÷∆100 mL0.1000 mol°§L£≠1Na2CO3»‹“ļ |
◊į÷√ĽÚ“«∆ų |
|
|
|
|
A.AB.BC.CD.D
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ“—÷™≥£ő¬Ō¬CH3COOHļÕNH3°§H2OĶńĶÁņŽ∆Ĺļ‚≥£ ż∑÷Īūő™Ka°ĘKb°£»Ű‘ŕ≥£ő¬Ō¬ŌÚ0.1mol/LĶńī◊ňŠ»‹“ļ÷–÷ūĶőľ”»ŽŌŗÕ¨Ň®∂»ĶńįĪňģ÷Ī÷ŃÕÍ»ęĻżŃŅ£¨‘ÚŌ¬Ń–ňĶ∑®’ż»∑Ķń «
A. ľ”»ŽįĪňģĶńĻż≥Ő÷–£¨»‹“ļĶńĶľĶÁ–‘“Ľ÷Ī≤Ľ∂Ō‘Ų«Ņ
B. CH3COONH4‘ŕňģ»‹“ļ÷–ĶńňģĹ‚∆Ĺļ‚≥£ żKh=Kw/(Ka+Kb)
C. »ŰKa°÷Kb£¨ĶĪľ”»ŽĶ»ŐŚĽżĶńįĪňģ Ī£¨»‹“ļĽýĪĺ≥ ÷––‘
D. ł√Ķ» Ĺ‘ŕĶőľ”Ļż≥Ő÷– ľ÷’≥…ŃĘc(CH3COO-)+c(CH3COOH)=c(NH4+)+c(NH3°§H2O)
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņń≥”–ĽķőÔA£¨ő™Ńň—–ĺŅ∆šĹŠĻĻļÕ–‘÷ £¨ĹÝ––»ÁŌ¬ Ķ—ť£ļ
£®1£©”√÷ ∆◊∑®≤‚Ķ√AĶńŌŗ∂‘∑÷◊”÷ ŃŅő™136£¨ĺ≠≤‚∂®A÷–÷Ľļ¨C°ĘH°ĘO»ż÷÷‘™ňō£¨«“CĶń÷ ŃŅ∑÷ żő™70.6%£¨HĶń÷ ŃŅ∑÷ żő™5.9%£¨‘ÚAĶń∑÷◊” Ĺ «_____
£®2£©ĺ≠≤‚∂®A «“Ľ÷÷∑ľŌ„◊ŚĽĮļŌőÔ£¨«“ń‹∑Ę…ķ“ÝĺĶ∑ī”¶£¨ń‹”ŽĹū Űń∆∑ī”¶…ķ≥…∆ÝŐŚ£¨≤Ľń‹”Ž![]() ∑Ę…ķŌ‘…ę∑ī”¶£¨∆šļňīŇĻ≤’Ů«‚∆◊”–5◊ť∑Ś£¨∑Ś√śĽż÷ģĪ»ő™1°√1°√2°√2°√2£¨‘Úł√”–ĽķőÔňýļ¨ĻŔń‹ÕŇĶń√Ż≥∆ «____£¨ĹŠĻĻľÚ Ĺ «______
∑Ę…ķŌ‘…ę∑ī”¶£¨∆šļňīŇĻ≤’Ů«‚∆◊”–5◊ť∑Ś£¨∑Ś√śĽż÷ģĪ»ő™1°√1°√2°√2°√2£¨‘Úł√”–ĽķőÔňýļ¨ĻŔń‹ÕŇĶń√Ż≥∆ «____£¨ĹŠĻĻľÚ Ĺ «______
£®3£©A”Ž–¬÷∆«‚—űĽĮÕ≠∑ī”¶ĶńĽĮ—ß∑Ĺ≥Ő Ĺ_______
£®4£©¬ķ◊„Ō¬Ń–ŐűľĢĶńAĶńÕ¨∑÷“žĻĻŐŚ”–_____÷÷
ĘŔń‹∑Ę…ķ“ÝĺĶ∑ī”¶ Ęŕń‹”Ž![]() ∑Ę…ķŌ‘…ę∑ī”¶
∑Ę…ķŌ‘…ę∑ī”¶
≤ťŅīīūįłļÕĹ‚őŲ>>
Ļķľ —ß–£”Ň—° - Ń∑Ōį≤ŠŃ–ĪŪ - ‘Ő‚Ń–ĪŪ
ļĢĪĪ °Ľ•Ń™ÕÝő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®∆ĹŐ® | ÕÝ…Ō”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | ĶÁ–Ň’©∆≠ĺŔĪ®◊®«Ý | …śņķ ∑–ťőř÷ų“Ś”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | …ś∆ů«÷»®ĺŔĪ®◊®«Ý
ő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®ĶÁĽį£ļ027-86699610 ĺŔĪ®” Ōš£ļ58377363@163.com