
【题目】下列物质的用途是利用其物理性质的是
选项 | 物质 | 用途 |
A | 四氢噻吩( | 作为杂质气体添加到家用天然气中,警示气体泄漏 |
B | 铁粉 | 装入透气纸袋中,用于富脂食品包装袋中 |
C | KMnO4 | 浸泡硅藻土,用作新鲜水果的保鲜剂 |
D | K2Cr2O7 | 用于酒驾检测仪中,检验司机是否酒驾 |
A.AB.BC.CD.D
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】(1)请用热化学方程式表示:
①1mol N2(g)与适量O2(g)起反应,生成2 mol NO2(g),吸收68kJ热量。___________
②4g CO在氧气中燃烧生成CO2,放出9. 6kJ热量_____________________________________
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
①反应的热化学方程式为_________________________________________________。
②又已知![]() ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是____________________kJ。
ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是____________________kJ。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某溶液中由水电离出的c(H+)和c(OH-)的乘积是1×10-20,下列说法中正确的是( )
A.该溶液的溶质不可能是NaHCO3B.该溶液的pH一定是10
C.该溶液的溶质不可能是NaHSO4D.该溶液的溶质可能是正盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表述正确的是( )
A.NH4Cl的水解常数表达式:![]()
B.NaHCO3水解的离子方程式:HCO3- + H2O ![]() H3O + + CO32-
H3O + + CO32-
C.结构示意图为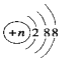 的阴离子都不能破坏水的电离平衡
的阴离子都不能破坏水的电离平衡
D.H2SO3的电离方程式:H2SO3![]() 2H+ + SO32-
2H+ + SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A.FeS2![]() SO2
SO2![]() H2SO4
H2SO4
B.N2![]() NH3
NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
C.Fe![]() FeCl2
FeCl2![]() FeCl3
FeCl3![]() Fe(OH)3
Fe(OH)3
D.MnO2![]() Cl2
Cl2![]() 漂白粉
漂白粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液在生产生活中应用十分广泛。回答下列问题:
(1)氯化铁可用作净水剂,其原因是(用离子方程式表示)___。
(2)水玻璃在工业上可作粘合剂,它与NH4Cl溶液接触时,会很快凝结并放出刺激性气味的气体,其原因是(用离子方程式表示)___。
(3)浓度均为0.1mol·L-1的下列各溶液:①HCl ②NaOH ③Na2CO3 ④CH3COONa ⑤NH4Cl ⑥H2SO4 ⑦KCl ⑧CH3COOH,pH由小到大的排列顺序为___。
(4)已知在0.1mol·L-1NaHSO3 溶液中滴入石蕊试液变红,则0.1mol·L-1NaHSO3溶液中离子浓度大小关系为:___。
(5)将mmol/L的醋酸和nmol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)=__mol/L,m与n的大小关系是m__n(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气在科研、生产中有广泛应用。

(1)在三个1L的恒容密闭容器中,分别加入0.1mol N2和0.3mol H2发生反应N2(g)+3H2(g)![]() 2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
①实验Ⅲ在前10分钟内N2平均反应速率v(N2)=_________________________;(写出计算过程)
②与实验Ⅱ相比,实验Ⅰ、实验Ⅲ分别采用的实验条件可能为_____________、__________________。
(2)常温下NH4+(aq)+H2O(l)![]() NH3H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10mol·L-1,则NH3H2O的电离平衡常数K=______________________(保留三位有效数字)。
NH3H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10mol·L-1,则NH3H2O的电离平衡常数K=______________________(保留三位有效数字)。
(3)常温下,将1mL pH均为11的氨水与NaOH溶液分别加水稀释,请在右图中画出两溶液的pH随体积稀释倍数的变化曲线______________(加必要标注)。
(4)工业上用NH3消除NO污染。在一定条件下,已知每还原1molNO,放出热量120kJ,请完成下列热化学方程式: NO(g)+ NH3(g)= N2(g)+______(g) ΔH2=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:

(1)100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为___mol·L-1·s-1。
(2)100℃时达到平衡后,改变反应温度为T,N2O4以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。则T___100℃(填“大于”或“小于”)。
(3)计算温度T时反应的平衡常数K2___(写出必要的计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】伞形花内酯的一种制备方法如下:
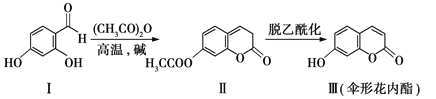
下列说法不正确的是
A.Ⅰ、Ⅱ、Ⅲ均能发生水解反应
B.Ⅰ、Ⅱ、Ⅲ均能使溴水褪色
C.检验化合物Ⅱ中是否混有化合物Ⅰ,可用FeCl3溶液
D.与化合物Ⅰ官能团种类、数目均相同且含有苯环的同分异构体有5种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com