
【题目】下列实验现象与实验操作不相匹配的是( )
A.将镁条点燃后迅速伸入集满![]() 的集气瓶,集气瓶中产生浓烟并有黑色颗粒产生
的集气瓶,集气瓶中产生浓烟并有黑色颗粒产生
B.向盛有![]() 溶液的试管中加过量铁粉,充分振荡后加1滴
溶液的试管中加过量铁粉,充分振荡后加1滴![]() 溶液,黄色逐渐消失,再加
溶液,黄色逐渐消失,再加![]() 后溶液颜色不变
后溶液颜色不变
C.将![]() 溶液加入
溶液加入![]() 溶液中,有白色沉淀生成,
溶液中,有白色沉淀生成,![]() 结合
结合![]() 的能力强于
的能力强于![]()
D.制取较高浓度的次氯酸溶液,将![]() 通入碳酸钠溶液中
通入碳酸钠溶液中
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。请回答下列问题:
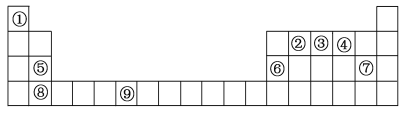
(1)上述元素中,属于s区的是__________ (填元素符号)。
(2)写出元素⑨的基态原子的价电子排布图________。
(3)元素的第一电离能:③________④(选填“大于”或“小于”)。
(4)元素③气态氢化物的VSEPR模型为________;该分子为________分子(选填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用下列方法制取NH3:
①固体Ca(OH)2与NH4Cl共热。
②NH4HCO3固体中加NaOH固体(过量),常温下即能产生NH3;装置如图。
![]()
③NaOH固体中加入浓氨水。
④NH4Cl浓溶液中加生石灰。
请回答下列问题:
(1)写出②方法制取氨气的化学方程式___________________________。
(2)说明③方法制取氨气的原理:_____________,为什么此法不加热? __________。
(3)请从下面的仪器中选择④方法制取氨气的发生装置________(写字母,要求使用仪器最少、合理)。

写出用NH4Cl浓溶液与生石灰反应制取氨气的理由:__________。

(4)某同学设计了如图装置收集氨气,下列说法不正确的是________(填字母)。
A.收集氨气的原理是向下排空气法
B.干燥管的作用是防止倒吸
C.当烧杯中的水变红时证明氨气已收集满
D.该装置会形成红色喷泉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是研究物质的组成,结构,性质以及变化规律的一门以实验为基础的学科,在给定条件下,下列物质间转化均能实现的一组是( )
(1)![]()
(2)![]()
(3)![]()
(4)![]()
A.(1)(2)B.(2)(3)C.(2)(4)D.(3)(4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 的
的![]() 溶液中逐滴滴加
溶液中逐滴滴加![]() 的
的![]() 溶液。溶液
溶液。溶液![]() 随滴入
随滴入![]() 溶液体积变化如图所示。下列说法正确的是( )
溶液体积变化如图所示。下列说法正确的是( )
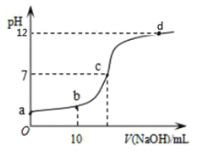
A.![]() 点的
点的![]()
B.![]() 点时,
点时,![]()
C.![]() 点时,
点时,![]()
D.从a→d,水的电离度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气中含有SO2和NOx(主要成分为NO和NO2的混合物),烟气的脱硫、脱硝技术是环境科学研究的热点。完成下列填空
(1)烟气脱硫、脱硝的环境意义是________________________________。
(2)液相氧化法采用碱性NaClO2溶液作为吸收剂,如脱除NO的原理为:____NaOH + ____NaClO2 + ____NO → ____NaNO3 + ____NaCl + ____H2O配平上述化学方程式。该反应中被还原的元素是_______________。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的脱除效果。如脱除SO2的原理为:ClO- + SO2 + H2O=Cl-+ SO42- + 2H+。结合平衡移动原理分析使用Ca(ClO)2脱硫效果为何较NaClO更好?____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是( )
A.摩尔是物质的量的单位
B.36g水中含氢原子数目为4NA(NA表示阿伏加德罗常数的值)
C.在0.5molNa2SO4中,含有的Na+数约是6.02×1023
D.等质量的O2与O3,所含氧原子数之比为3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以纯铜屑为原料制取的流程如下:
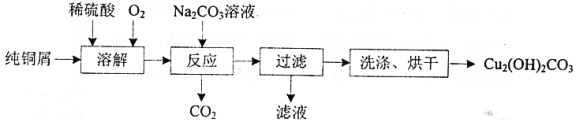
(1)“溶解”步骤反应的离子方程式为_______.温度宜控制在50℃左右,若高于50℃,溶液中O2溶解量减少、Cu的转化率降低,若低于50℃ ,_____
(2)“反应”步骤生成Cu2(OH)2CO3的化学方程式为_________。反应后溶液中铜元素残留量受pH和反应时间的影响如图所示:
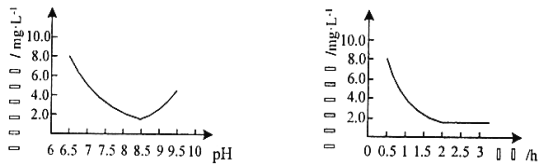
判断反应的最佳条件: pH为___、反应时间为____h。
(3)检验Cu2(OH)2CO3洗涤是否完全的方法是____________________
(4) Cu2(OH)2CO3也可以表示为CuCO3·Cu(OH)2。 查阅文献,上述反应条件下还可能生成少量CuCO3·Cu(OH)2。为测定产品的纯度[产品中Cu2(OH)2CO3的质量分数],取10.97g干燥样品,400℃左右加热,测得固体质量随时间变化关系如图所示。
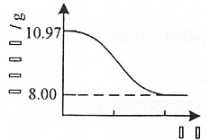
已知: 8.00g固体为黑色纯净物。
有关物质的摩尔质量如表:
物质 | CuCO3·Cu(OH)2 | CuCO3·2Cu(OH)2 | CuO |
摩尔质量/g·mol-1 | 222 | 320 | 80 |
请计算产品的纯度(写出计算过程,结果保留3位有效数字)。______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com