
【题目】下列物质的水溶液,滴入酚酞可能变红的是
A. CH3COONa B. NH4Cl C. NaCl D. NaHSO4
【答案】A
【解析】
能使酚酞变红的溶液呈现碱性,再结合盐类“有弱才水解,无弱不水解,谁强显谁性”的基本水解规律分析作答。
在水溶液中滴入酚酞可能变红的溶液显碱性,
A. CH3COONa在溶液中发生水解,其水解方程式为:CH3COO-+H2O![]() CH3COOH+OH-,溶液水解显碱性,能使酚酞变红,故A项正确;
CH3COOH+OH-,溶液水解显碱性,能使酚酞变红,故A项正确;
B. NH4Cl在溶液中发生水解,其水解方程式为:NH4++H2O![]() NH3·H2O+H+,溶液水解显酸性,不能使酚酞变红,故B项错误;
NH3·H2O+H+,溶液水解显酸性,不能使酚酞变红,故B项错误;
C. NaCl在水溶液中不水解,溶液显中性,故C项错误;
D. NaHSO4为强电解质,在水溶液中存在的电离方程式为NaHSO4=Na++H++SO42-,溶液显酸性,故D项错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】 反应A(g)+3B(g)![]() 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率
分别如下,其中反应速率最大的是( )
A.v(C)=0.04 mol/(L·s)
B.v(B)=0.06 mol/(L·min)
C.v(A)=0.15 mol/(L·min)
D.v(D)=0.01 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是

A. 对应简单离子半径:W>X
B. 对应气态氢化物的稳定性:Y<Z
C. 化合物XZW既含离子键,又含极性共价键
D. Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象关系合理的是
A.  向pH=9的NaOH溶液中不断加水
向pH=9的NaOH溶液中不断加水
B.  在久置的NaOH溶液中加入盐酸
在久置的NaOH溶液中加入盐酸
C.  分别向稀盐酸中加入等质量的Fe和Mg
分别向稀盐酸中加入等质量的Fe和Mg
D.  在饱和的KNO3溶液中加入KNO3晶体
在饱和的KNO3溶液中加入KNO3晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2(g)+O2(g)=2H2O(l) ΔH=-569.6kJ/mol,2H2O(g)=2H2(g)+O2(g) ΔH=+482.1 kJ/mol。现有1g液态H2O,蒸发时吸收的热量是 ( )
A. 2.43 kJ B. 4.86 kJ C. 43.8 kJ D. 87.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是
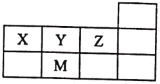
A. 原子半径:M>Z>Y>X
B. Z的气态氢化物最稳定,因其分子间存在氢键
C. 最高价氧化物对应水化物的酸性M<Z
D. 元素的非金属性:X<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10 mL 4.0 mol/L H2O2发生分解:2H2O2![]() H2O+ O2
H2O+ O2![]() ,不同时刻测定生成O2的体积(已折算为标准状况)如下表:
,不同时刻测定生成O2的体积(已折算为标准状况)如下表:
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述正确的是(溶液体积变化忽略不计)
A. 6 min时反应速率υ(H2O2) = 3.33×10-2 mol/(L·mol)
B. 反应到6 min时,H2O2分解率为50%
C. 其他条件不变,若换用更高效的催化剂,达到平衡时将会得到更多氧气
D. 随时间增长得到的氧气更多,说明反应速率逐渐加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前海水液化可采用双极膜电液析法、同时获得副产品,其模拟工作原理如图所示。其中双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源。M、N为离子交换膜。下列说法正确的是( )

A. X电极为电解池的阴极,该电极反应式为:2H+-2e-=H2↑
B. 电子流向:电源负极→X电极→Y电极→电源正极
C. 电路中每转移1mol电子,X、Y两极共得到标准状况下16.8L的气体
D. M为阳离子交换膜,A室获得副产品NaOH;若去掉B室双极膜,B室产物不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com