
【题目】现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是( )
A. 加入10mL 0.08mol·L-1的NaOH溶液 B. 加入100mL 的水进行稀释
C. 加水稀释成1L D. 加入10mL 0.01mol·L-1的盐酸溶液
【答案】A
【解析】
pH = -lgc(H+),常温下pH = 1的某强酸溶液中c(H+) = 0.1 mol/L,使溶液的pH变成2,即c(H+) = 0.01mol/L,可加水稀释或加入一定量的碱进行中和。
pH = -lgc(H+),常温下pH = 1的某强酸溶液中c0(H+) = 0.1 mol/L,n0(H+) = 0.1 mol/L × 0.01 L =0.001 mol,使溶液的pH变成2,则
A. 10 mL 0.08 mol/L的NaOH溶液,n0(OH-) = 0.01 L × 0.08 mol/L = 0.0008 mol,n0(H+)>n0(OH-),则混合后c(H+) = ![]() = 0.01mol/L,pH = -lgc(H+) = 2,故A项正确;
= 0.01mol/L,pH = -lgc(H+) = 2,故A项正确;
B. 加入100 mL的水进行稀释,混合后c(H+) = ![]() 0.0091 mol/L≠0.01mol/L,故B项错误;
0.0091 mol/L≠0.01mol/L,故B项错误;
C. 加水稀释成1 L,c(H+) = ![]() = 0.001 mol/L≠0.01mol/L,故C项错误;
= 0.001 mol/L≠0.01mol/L,故C项错误;
D. 加入10 mL 0.01 mol/L的盐酸,混合后,c(H+) = ![]() = 0.055 mol/L ≠ 0.01 mol/L,故D项错误;
= 0.055 mol/L ≠ 0.01 mol/L,故D项错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
| C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯, 易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 易升华 | |
沸点/℃ | 132 | 173 | ||
(1)用H2还原无水FeCl3制取FeCl2。有关装置如下:

①H2还原无水FeCl3制取FeCl2的化学方程式为_____________。
②按气流由左到右的方向,上述仪器的连接顺序为_________(填字母,装置可多次使用);C中盛放的试剂是_____________。
③该制备装置的缺点为________________。
(2)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按下图装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。

①仪器a的名称是__________。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是____,回收滤液中C6H5C1的操作方法是______。
③反应后将锥形瓶中溶液配成250mL,量取25.00mL所配溶液,用0.40mol/LNaOH溶液滴定,终点时消耗NaOH溶液为19.60 mL,则氯化铁的转化率为__________。
④为了减少实验误差,在制取无水FeCl2过程中应采取的措施有:________(写出一点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据反应2KIO3+5SO2+4H2O═I2+3H2SO4+2KHSO4(KIO3过量),利用下列装置从反应后的溶液中制取碘的CCl4溶液并回收KHSO4。下列说法不正确的是
A. 用 制取SO2B. 用
制取SO2B. 用 还原IO3-
还原IO3-
C. 用 从水溶液中提取KHSO4D. 用
从水溶液中提取KHSO4D. 用 制取I2的CCl4溶液
制取I2的CCl4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物R是金银花的一种成分,具有广谱抗病毒功效,键线式为 (已知CH2=CHCH2OH的键线式为
(已知CH2=CHCH2OH的键线式为![]() )。下列说法错误的是( )
)。下列说法错误的是( )
A.R能发生加成、氧化、取代反应
B.用酸性高锰酸钾溶液可以确认R含碳碳双键
C.R分子中所有碳原子可能共平面
D.![]() CHO与R互为同分异构体
CHO与R互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液存在H2CO3/HCO3—、HPO42-/H2PO4—等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值lg x[x表示![]() 或
或![]() ]与pH的关系如图所示。已知碳酸pKal═6.4、磷酸pKa2═7.2 (pKa═ -lgKa)。则下列说法不正确的是
]与pH的关系如图所示。已知碳酸pKal═6.4、磷酸pKa2═7.2 (pKa═ -lgKa)。则下列说法不正确的是

A. 曲线Ⅱ表示lg![]() 与pH的变化关系
与pH的变化关系
B. a~b的过程中,水的电离程度逐渐增大
C. 当c(H2CO3) ═c (HCO3—)时,c(HPO42—)=c(H2PO4—)
D. 当pH增大时,![]() 逐渐增大
逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢是人们公认的清洁能源,作为低碳和零碳能源正在脱颖而出,氢的获得及以氢为原料的工业生产工艺成为科技工作者研究的重要课题。
(1)工业生产中可利用H2还原CO2制备清洁能源甲醇。
①将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率与温度的变化如图所示:
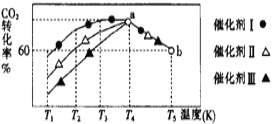
催化效果最好的是催化剂_____________(选填“Ⅰ”“Ⅱ”或“Ⅲ”),该反应在a点达到平衡状态,a点的转化率比b点的高,其原因是______________________________________________________。
②甲醇(CH3OH)燃料电池(NaOH溶液介质)的负极电极反应式 ___________。
(2)利用CO和水蒸气可生产H2,反应的化学方程式:CO(g)+H2O(g)![]() CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中进行如下反应,得到三组数据如下表所示:
CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中进行如下反应,得到三组数据如下表所示:

①该反应的正反应为___________反应(选填“放热”或“吸热” )。
②900℃时,达到平衡时的反应速率v(H2O)=____________,达到平衡时c(H2)=__________(保留2位小数)。
(3)利用废弃的H2S的热分解可生产H2:2H2S(g)![]() 2H2(g)+S2(g)。现将0.20 mol H2S(g)通入到某恒压(压强p=a MPa)密闭容器中,在不同温度下测得H2S的平衡转化率如下图所示:
2H2(g)+S2(g)。现将0.20 mol H2S(g)通入到某恒压(压强p=a MPa)密闭容器中,在不同温度下测得H2S的平衡转化率如下图所示:
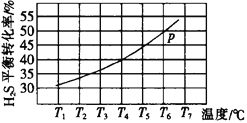
已知:对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可表示平衡常数。 温度为T4℃时,该反应的平衡常数Kp=___________(用a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下列装置探究苯酚、醋酸、碳酸的酸性强弱,下列说法不正确的是( )

A. 装置a中试剂为醋酸,b中试剂为碳酸钠固体
B. 装置c中试剂为饱和碳酸氢钠溶液
C. 装置d中试剂为苯酚溶液
D. 酸性强弱顺序为:醋酸>碳酸>苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列叙述中,正确的是( )
A.氧气的摩尔质量是32
B.2molNaCl固体溶解于1L水所得溶液的物质的量浓度为2mol/L
C.标准状况下同体积的O2和O3中所含分子数相等
D.在标准状况下,体积为22.4L的物质都是1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)NaClO中Cl的化合价为__________,有较强的_________(填氧化、还原)性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式_________。
(2)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为_____________________。
②ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为_________________。
(3)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应可以回收S,其物质转化如图所示。在图示的转化中,化合价不变的元素是__________。该图示的总反应为_______

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com