
【题目】下列两种物质相互作用,反应条件或者反应物用量改变,不会引起产物种类改变的是( )
A.Na和O2B.NaOH和CO2C.Fe和Cl2D.HCl和Na2CO3
【答案】C
【解析】
A.常温下生成氧化钠,点燃或加热生成过氧化钠,4Na+O2=2Na2O、2Na+O2 ![]() Na2O2,反应温度不同其产物不同,故A错误;
Na2O2,反应温度不同其产物不同,故A错误;
B.氢氧化钠与二氧化碳反应,二氧化碳不足时生成碳酸钠,CO2+2NaOH═Na2CO3+H2O,二氧化碳过量时生成碳酸氢钠,Na2CO3+H2O+CO2═2NaHCO3,反应物用量比改变,会引起产物的种类改变,故B错误;
C.氯气具有较强的氧化性,铁和氯气反应只生成氯化铁,与量以及温度无关,故C正确;
D.在Na2CO3溶液中滴加稀盐酸,若盐酸少量产物为NaHCO3和NaCl,盐酸过量产物为NaCl、H2O和CO2,故D错误;
故答案为C。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】有BaCl2和NaCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗amolH2SO4、bmolAgNO3。则原混合溶液中的c(Na+)为( )
A. ![]() mol/LB.
mol/LB. ![]() mol/LC.
mol/LC. ![]() mol/LD.
mol/LD. ![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:
Cu2S+2Cu2O=6Cu+SO2↑,关于该反应的说法中正确的是
A.该反应的氧化剂与还原剂物质的量之比为2:1
B.Cu2S 在反应中只做还原剂
C.Cu 是氧化产物,SO2是还原产物
D.每生成38.4gCu,反应中转移0.6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量的NO2气体,且起始时体积相同。发生反应:2NO2(g)![]() N2O4(g)△H<0。一段时间后达到平衡状态,下列说法中正确的是
N2O4(g)△H<0。一段时间后达到平衡状态,下列说法中正确的是
A.该反应的平衡常数表达式K=![]()
B.达到平衡所需时间,甲与乙相等
C.平衡时NO2体积分数:甲<乙
D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HClO4、H2SO4、HNO3和HCl都是强酸,它们的酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
下列说法中不正确的是( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4===2H++SO![]()
D.水不能区分这四种酸的强弱,但冰醋酸可以区分这四种酸的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol过氧化钠与1.6mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是 ( )
A. Na2CO3 B. NaOH、Na2CO3 C. Na2O2、 Na2CO3 D. Na2O2、 NaOH 、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
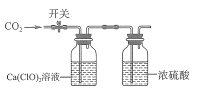
【题目】现有 100 mL 0.5 mol/LCa(CIO)2溶液,向其中缓慢通入CO2(如图所示)。下列说法错误的是
已知:①![]()
②溶液中粒子浓度可用以下公式计算:![]()
![]()
A.0.01 mol CO2通入溶液时发生反应的化学方程式为![]()
B.通入0.1 mol CO2后,用HNO3维持体系 pH=6,此时溶液中粒子浓度大小关系为c(HCO3-)>c(HCIO)>c(Ca2+)
C.迅速通入0.05 mol CO2后,关闭开关,久置后发现体系中沉淀减少
D.缓慢通入0.05 mol CO2的过程中,水的电离程度一直减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在150℃时碳酸铵可以受热完全分解,(NH4)2CO3 ![]() 2NH3↑ + H2O↑ + CO2↑,则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的几倍
2NH3↑ + H2O↑ + CO2↑,则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的几倍
A. 96倍 B. 48倍 C. 12倍 D. 32倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种银白色的过渡金属,有良好的抗腐蚀性,是强度重量比最高的金属。请回答下列问题:
⑴基态钛原子核外共有_____个填充了电子的原子轨道,其外围电子的轨道表达式为_____。
⑵金属钛有两种同素异形体。
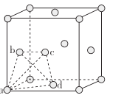
①在较高温度时具有体心立方晶胞,其空间利用率为_______(用含π的式子表示)。
②在较低温度时,采用面心立方最密堆积,其晶胞中有若干个正四面体空隙(如下图中a、b、c、d四个钛原子形成一个正四面体,其内部为正四面体空隙),可以填充其他原子。若晶胞中所有的正四面体空隙中都填充1个氢原子,则形成的氢化钛的化学式为________。
⑶金属钛的熔点、硬度均比铝大,可能的原因是_______。
⑷TiCl4是氯化法制取钛的中间产物。TiCl4和SiCl4在常温下都是液体,分子结构相同。采用蒸馏的方法分离TiCl4和SiCl4的混合物,先获得的馏分是_______(填化学式)。
⑸有机合成中某种含钛催化剂的结构如图所示。
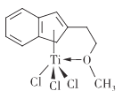
①组成该催化剂的元素中,电负性最大的是____(填元素名称)。
②该催化剂中碳原子的杂化方式为_____。
⑹配合物[TiCl(H2O)5]Cl2的配位数是__, 向含1 mol该配合物的水溶液中加入足量AgNO3溶液,可生成AgCl沉淀的物质的量为__。
⑺腈化钛(TiCN)可用于制备空气净化材料,已知氰气分子[(CN)2]中所有原子均满足最外层8电子稳定结构,则氰气分子中σ键和π键的个数比为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com