
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述错误的是
H++CH3COO-,下列叙述错误的是
A. 向溶液中加少量的CH3COONa固体,平衡逆向移动,c(CH3COO-)增大
B. 0.10mol/L的CH3COOH溶液中加少量水,平衡正向移动,导电性增强
C. 通入少量NH3气体,c(H+)减小、c(OH-)增加
D. 25℃时,加入少量浓醋酸,平衡正向移动,醋酸的电离程度减弱
科目:高中化学 来源: 题型:
【题目】氰化钠(NaCN)是一种重要的化工原料,在工业上有许多用途。NaCN有剧毒,含氰废水的工业处理流程如图所示。

已知:Ka(HCN)< Ka(CH3COOH),[Ag(CN)2]-(aq)![]() Ag+(aq)+2CN-(aq)。
Ag+(aq)+2CN-(aq)。
(1)氰化钠遇水会产生剧毒氢氰酸,写出该反应的离子方程式:_____________________________。
当物质的量浓度相同时,CH3COOH中水电离出的c(H+)_____________(填“大于”、“小于”或“等于”)HCN中水电离出的c(H+)。
(2)向发生塔中通入水蒸气的目的是____________________________________________________。
(3)氧化池中,C1O2可将CN-氧化。且产生两种无毒气体,当反应过程中转移了 6.02×1023个电子时,生成标准状况下气体的总体积是_____________L。
(4)氧化池中,也可用H2O2代替C1O2,反应后生成一种能使红色石蕊试纸变蓝的气体和一种常见的酸式盐,写出该反应的离子方程式:_______________________________________________________。
(5)电镀厂电镀银时需要降低镀层金属的沉积速率,使镀层更加致密。若电解液使用Na[Ag(CN)2]溶液,则阴极反应式为__________________________________________;解释工业电镀中使用氰离子(CN-)的原因:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂质的操作方法正确的是( )
A.NO中有少量的NO2:用水洗涤后再干燥
B.食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干
C.N2中有少量的CO:通过灼热的氧化铜
D.NO2中有少量NH3:用水洗涤后干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1 mol·L-1的NaOH溶液。整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是
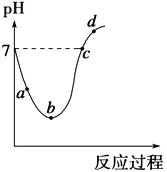
A. 实验进程中水的电离程度:a>c>b
B. 向a点所示溶液中通入SO2,溶液的pH减小,漂白性增强
C. c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO)
D. d点所示的溶液中c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着工农业发展,NH4Cl的需求显著降低,价格低迷和产品积压导致利用“侯氏制碱法”生产的碱厂出现亏损。新联合制碱法在此基础上将氯元素转化为更有应用价值的HCl。

(1)气体X是__________。
(2)已知25℃时部分物质的溶解度数据:
物质 | NaCl | NaHCO3 | NH4Cl | NH4HCO3 |
溶解度/g | 36.0 | 10.3 | 39.5 | 24.8 |
结合表中数据说明过程Ⅰ中的反应能发生的原因是______________。
(3)过程Ⅰ获得的NaHCO3会吸附微量NH4Cl,导致产品Na2CO3中混有NaCl。
①用化学方程式表示过程Ⅱ中NaCl生成的原因:_____________。
②检验Na2CO3中NaCl的实验操作是,取少量固体于试管中_____________。
(4)过程Ⅲ以MgO为催化剂,在不同温度下加热灼烧,将NH4Cl分解为NH3和HCl。

①步骤i中反应的化学方程式是____________。
②过程Ⅲ的优点是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期主族元素,其原子序数依次增大。其中A元素原子核内只有一个质子;A与C、B与D分别同主族;B、D两元素原子序数之和是A、C两元素原子序数之和的2倍。
请回答下列问题:
(1)由上述元素组成的下列物质中属于非电解质的是____(填字母)。
A.A2B B.DB2 C.E2 D.C2DB3
(2)D元素在元素周期表中的位置为____;化合物C2B中两种离子的半径大小关系为(填离子符号,下同)_________>____。
(3)实验室中欲选用如图所示装置制取并收集纯净干燥的E2气体。
①实验中应选用的装置为_______(按由左到右的连接顺序填写)。
②装置A中发生反应的离子方程式为______。


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com