
【题目】下列反应是工业生产硝酸的一个反应过程,4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-1025 kJ/mol,若反应物起始的物质的量相同。下列关于该反应的示意图不正确的是
4NO(g)+6H2O(g) ΔH=-1025 kJ/mol,若反应物起始的物质的量相同。下列关于该反应的示意图不正确的是
A.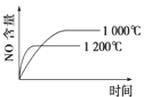 B.
B.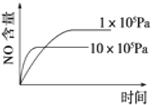
C.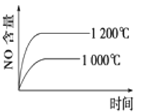 D.
D.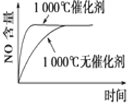
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】铈(Ce)是镧系金属元素。空气污染物NO通常用含Ce4+的溶液吸收,生成HNO2、NO3ˉ,再利用电解法将上述吸收液中的HNO2转化为无毒物质,同时生成Ce4+,其原理如图所示。下列说法正确的是
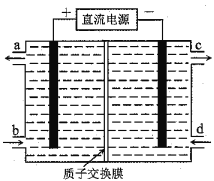
A. H+由右室进入左室
B. Ce4+从电解槽的c口流出,且可循环使用
C. 阴极的电极反应式:2HNO2+6H++6eˉ=N2↑+4H2O
D. 若用甲烷燃料电池作为电源,当消耗标准状况下33.6L甲烷时,理论上可转化HNO22mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是________。欲除去Cu2+,最好选用下列试剂中的________(填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是________。若电解电路中通过2 mol电子,MnO2的理论产量为________。
(4)用间接电化学法除去NO的过程,如下图所示:

已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:_____________。用离子方程式表示吸收池中除去NO的原理:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于 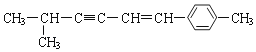 说法正确的是
说法正确的是
A.该分子中所有的碳原子均可能处于同一平面上
B.该分子中一定共面的碳原子数至少为8个
C.该分子中至少有9个碳原子处于同一条直线上
D.该分子中可能处于同一平面的原子总数最多为18个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸是一种常见的弱酸,请回答:
(1)已知某温度时,醋酸的电离平衡常数Ka=1.6×10-5。
①醋酸的起始浓度为0.010mol/L,平衡时c(H+)=______(提示:醋酸的电离平衡常数很小,平衡时的c(CH3COOH)可近似视为仍等于0.010mol/L
②pH=1的醋酸与pH=l的盐酸等体积混合,混合后溶液中c(CH3COO-)=_______。
(2)日常生活中常用醋酸除水垢,但工业锅炉的水垢中常含有CaSO4,需先用________(填化学式)溶液处理,而后用盐酸去除。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液有许多奇妙之处,你只有深入的去思考,才能体会到它的乐趣。下列关于电解质溶液的叙述中正确的是( )
A.浓度相同的![]() 、
、![]() 两种盐溶液中,所有阴离子总浓度后者大
两种盐溶液中,所有阴离子总浓度后者大
B.常温下,1![]() 的
的![]() 溶液与1
溶液与1![]() 的NaOH溶液混合后,所得混合液中:
的NaOH溶液混合后,所得混合液中:![]()
C.物质的量浓度相同的![]() 和
和![]() 两种溶液中,
两种溶液中,![]() 前者小于后者
前者小于后者
D.常温下,某溶液中由水电离出的![]() ,则此溶液可能是盐酸
,则此溶液可能是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年12月15日,全球第一款不依赖专业充电站的双模电动车--比亚迪F3DM双模电动车在深圳正式上市.比亚迪F3DM双模电动车代表着“科技![]() 绿色明天”,运用了众多高新科技,开启了电动车的新时代,同时也实现了中国力量领跑世界.镍镉
绿色明天”,运用了众多高新科技,开启了电动车的新时代,同时也实现了中国力量领跑世界.镍镉![]() 可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:![]() 有关该电池的说法正确的()
有关该电池的说法正确的()
A.充电过程是化学能转化为电能的过程
B.充电时阳极反应:![]()
C.放电时负极附近溶液的酸性增强
D.放电时电解质溶液中的![]() 向正极移动
向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】一定温度下,反应N2(g)+3H2(g)![]() 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
A. c(N2):c(H2):c(NH3)=1:3:2
B. N2、H2和NH3的物质的量分数不再改变
C. N2与H2的物质的量之和是NH3的物质的量的2倍
D. 单位时间里每增加lmolN2,同时增加3molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬酸钾![]() 为原料,用电化学法制备重铬酸钾
为原料,用电化学法制备重铬酸钾![]() 的实验装置如图,其反应原理可表示为4K2CrO4+4H2O
的实验装置如图,其反应原理可表示为4K2CrO4+4H2O![]() 2K2Cr2O7+4KOH+2H2↑+O2↑,下列说法中正确的是( )
2K2Cr2O7+4KOH+2H2↑+O2↑,下列说法中正确的是( )
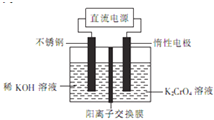
A.在阴极室,随着反应的进行溶液的pH逐渐变小
B.不锈钢电极上生成![]() ,惰性电极上得到
,惰性电极上得到![]()
C.惰性电极发生的电极反应为![]()
D.不锈钢应连接直流电源的正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com