
【题目】有四种短周期元素,它们的结构、性质等信息如下表所示:
元素 | 结构、性质等信息 |
A | 是元素周期表中(除稀有气体外)原子半径最大的元素,该元素某种合金是原子反应堆导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
E | L层上有2对成对电子 |
请根据表中信息填写:
(1)B原子的简化电子排布式_____。
(2)A元素在周期表中的位置_____;离子半径:A_____B(填>、=或< )。
(3)E原子的价电子排布图是____,其原子核外有______个未成对电子,能量最高的电子为_____轨道上的电子,其轨道呈_____形。
(4)D原子的外围电子排布式为____,D-的离子结构示意图是_____。
(5)C、E元素的第一电离能的大小关系是_____(用元素符号表示,下同)。
(6)已知CD3分子中D元素为+1价,则C、D的电负性大小关系是____,CD3的中心原子杂化轨道类型是___,CD3与水反应的化学方程式是_____。
【答案】[Ne]3s23p1 第三周期第ⅠA族 > ![]() 2 p或2p 哑铃 3s23p5
2 p或2p 哑铃 3s23p5 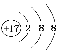 N>O N>Cl sp3 NCl3+4H2O=NH3·H2O+3HClO或NCl3+3H2O=NH3+3HClO
N>O N>Cl sp3 NCl3+4H2O=NH3·H2O+3HClO或NCl3+3H2O=NH3+3HClO
【解析】
先根据元素的结构、性质等推断元素。A是元素周期表中(除稀有气体外)原子半径最大的元素,该元素某种合金是原子反应堆导热剂,则A是Na元素;B与A同周期,其最高价氧化物的水化物呈两性,则B是Al元素;元素C的气态氢化物极易溶于水,可用作制冷剂,则C是N元素,该氢化物是NH3;D是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,则D是Cl元素;E元素的L层上有2对成对电子,则E核外电子排布是1s22s22p4,E是O元素。然后结合原子核外电子排布规律、元素周期律及元素和化合物的性质逐一分析解答。
根据上述分析可知:A是Na;B是Al;C是N;D是Cl;E是O元素。
(1)B是Al元素,其原子核外电子排布式是1s22s22p63s23p1,Al的简化电子排布式[Ne] 3s23p1;
(2)A是Na,核外电子排布是2、8、1,故该元素在周期表中的位置是位于第三周期第IA族;Na+、Al3+核外电子排布都是2、8,由于核电荷数越大,离子半径越小,所以离子半径:Na+>Al3+;
(3)E是O,O核外电子排布式是1s22s22p4,故O原子的价电子排布图是![]() ;其原子核外有2个未成对电子;能量最高的电子为2p轨道上的电子,其轨道呈哑铃形或纺锤形;
;其原子核外有2个未成对电子;能量最高的电子为2p轨道上的电子,其轨道呈哑铃形或纺锤形;
(4)D是Cl,原子的外围电子排布式为3s23p5,Cl-是Cl原子得到1个电子形成的微粒,故Cl-的离子结构示意图是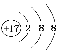 ;
;
(5)C是N,核外电子排布式为1s22s22p3;E是O,O元素的核外电子排布式为1s22s22p4;由于N元素的最外层电子2p电子处于半充满的稳定状态,失去1个电子比O元素难,故N元素第一电离能比O元素的第一电离能的大,即第一电离能:N>O;
(6)在NCl3分子中Cl元素为+1价,N为+3价,说明N、Cl的电负性大小关系是:N>Cl;在NCl3中N元素形成了3对共用电子对,N原子上还有1对孤电子对,故N原子的杂化轨道类型是sp3杂化,NCl3与水反应产生NH3和HClO,该反应的化学方程式是NCl3+3H2O=NH3+3HClO,也可以写为NCl3+4H2O=NH3·H2O+3HClO。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】工业上常用水钴矿(主要成分为Co2O3,还含少量Fe2O3、Al2O3、MgO、CaO等杂质)制备钴的氧化物,其制备工艺流程如下(已知Na2SO3能还原Fe3+和Co3+):

回答下列问题:
(1)在加入盐酸进行“酸浸”时,能提高“酸浸”速率的方法有______________(任写2种)。
(2)“酸浸”后加入Na2SO3钴的存在形式为Co2+,产生Co2+反应的离子方程式为________
(3)溶液a中加入NaClO的作用是___________________________________
(4)沉淀a的成分是__________(写化学式),操作2的名称是_______________
(5)溶液d中的金属离子只有Co2+和Na+两种,则溶液c中加入NaF溶液的作用是________
(6)在空气中缎烧CoC2O4生成钴的某种氧化物和CO2,测得充分煅烧后固体质量为12.05g,CO2的体积为6.72L(标准状况),则此反应的化学方程式为____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g)![]() CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的△H也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学生设计的用氨催化法制取少量HNO3溶液的实验装置如图所示:
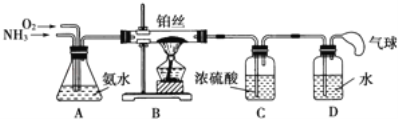
(1)实验室制备NH3,下列方法中适宜选用的是 (填序号).
①固态氯化铵与熟石灰混合加热 ②固态氯化铵加热分解
③碱石灰中滴加浓氨水 ④氯化铵溶液与氢氧化钠溶液共热
(2)装置B中发生反应的化学方程式为 .
(3)装置C的作用是 ;
装置C中的现象是 ;为确保装置D中尽可能多地生成HNO3,所通入O2和NH3的体积比应大于 .
(4)装置D中发生的反应化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA表示阿伏加德罗常数的值,下列说法错误的是( )
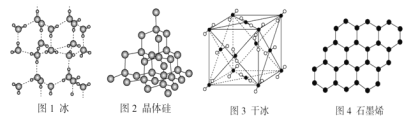
A.18 g冰(图1)中含O—H键数目为2NA
B.28 g晶体硅(图2)中含有Si—Si键数目为2NA
C.44 g干冰(图3)中含有4NA个CO2分子
D.石墨烯(图4)是碳原子单层片状新材料,12 g石墨烯中含C—C键数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠![]() 俗称保险粉,可以用作染色工艺的还原剂,纸浆、肥皂等的漂白剂。
俗称保险粉,可以用作染色工艺的还原剂,纸浆、肥皂等的漂白剂。![]() 易溶于水,难溶于乙醇,在碱性介质中较稳定,在空气中易被氧化。回答下列问题:
易溶于水,难溶于乙醇,在碱性介质中较稳定,在空气中易被氧化。回答下列问题:
![]() 在潮湿空气中氧化,生成的两种常见酸式盐是________
在潮湿空气中氧化,生成的两种常见酸式盐是________![]() 填化学式
填化学式![]() 。
。
![]() 锌粉法制备
锌粉法制备![]() 的工艺流程如下图所示:
的工艺流程如下图所示:
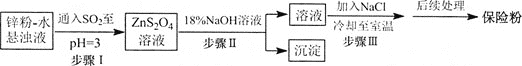
![]() 工业上常将锌块进行预处理得到锌粉
工业上常将锌块进行预处理得到锌粉![]() 水悬浊液,其目的是________。
水悬浊液,其目的是________。
![]() 步骤Ⅰ中发生反应的化学方程式为________。
步骤Ⅰ中发生反应的化学方程式为________。
![]() 在步骤Ⅲ中得到的
在步骤Ⅲ中得到的![]() 固体要用乙醇洗涤,其优点是________,“后续处理”最终要加入少量的
固体要用乙醇洗涤,其优点是________,“后续处理”最终要加入少量的![]() 固体,其原因是________。
固体,其原因是________。
![]() 目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙醇水溶液中,然后通入
目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙醇水溶液中,然后通入![]() 发生反应,有
发生反应,有![]() 气体放出,总反应的离子方程式是________。
气体放出,总反应的离子方程式是________。
![]() 有人设计了图示方法同时制备连二亚硫酸钠和过二硫酸钠
有人设计了图示方法同时制备连二亚硫酸钠和过二硫酸钠![]() ,并获得中国专利。电解过程中,阴极室生成
,并获得中国专利。电解过程中,阴极室生成![]() ,a极的电极反应式为________,通过阳离子交换膜的离子主要是
,a极的电极反应式为________,通过阳离子交换膜的离子主要是![]() ,其迁移方向是________。
,其迁移方向是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是
A.0.1 mol·L-1NaHSO4溶液中:c(Na+)>c(SO42-)>c(H+) >c(OH-)
B.0.1 mol·L-1Na2S溶液中:2 c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:C(Na+)=c(CH3COO-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.汽油、煤油、柴油均可来自于石油的分馏
B.甲烷与氯气在一定条件下反应,经分离提纯后可得到四氯化碳
C.相同物质的量的乙炔和苯在足量的氧气中完全燃烧,消耗氧气的质量相同
D.煤气化生成的CO和![]() 再经过催化合成可得到液体燃料
再经过催化合成可得到液体燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A.“一代材料,一代飞机”,据悉2017年国产大飞机C919中使用了素有“现代工业骨骼”之称的碳纤维,碳纤维是一种新型的有机高分子材料
B.离子交换膜在工业上应用广泛,如在氯碱工业中使用的阴离子交换膜
C.雾霾是一种分散系,带活性炭口罩的原理是吸附作用
D.煤炭经蒸馏,气化,液化等过程,可获得清洁能源和重要的化工原料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com