
【题目】室温时,向20mL0.1mol/L醋酸溶液中不断滴入0.1mol/L的NaOH溶液,溶液pH变化如图所示。下列叙述错误的是

A. a点:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B. b点:c(Na+)=c(CH3COOH)+c(CH3COO-)
C. C点:c(OH-)=c(CH3COOH)+c(H+)
D. d点:2c(Na+)=3[c(CH3COOH)+c(CH3COO-)]
【答案】B
【解析】反应进行到a点时,溶液中的溶质为CH3COOH和CH3COONa(1:1),据电荷守恒得到c(Na+)+c(H+)=c(CH3COO-)+c(OH-),据物料守恒2c(Na+)=c(CH3COOH)+ c(CH3COO-),整理得到c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),A正确;反应进行到b点,溶液呈中性c(H+)= c(OH-),溶液中电荷守恒规律c(Na+)+c(H+)=c(CH3COO-)+c(OH-),得c(Na+)= c(CH3COO-),B错误;反应进行到c点,醋酸与氢氧化钠恰好完全反应生成醋酸钠,据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),据物料守恒得c(Na+)= c(CH3COO-)+ c(CH3COOH),整理后得到c(OH-)=c(H+)+c(CH3COOH),C正确;反应进行到d时,溶液中溶质为NaOH和CH3COONa混合物(1:2)根据Na+和原子团“CH3COO”守恒得出溶液中物料守恒为规律为:2c(Na+)=3 c(CH3COO-)+3 c(CH3COOH),D正确;正确选项B。


科目:高中化学 来源: 题型:
【题目】将足量NO2通入下列各溶液中,所含离子还能大量共存的是( )
A. Fe2+、Cl-、SO42-、Na+B. NH4+、Al3+、NO3-、Cl-
C. Ca2+、K+、Cl-、HCO3-D. K+、Na+、SO32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于图中各装置的叙述不正确的是

A. 装置①能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀
B. 装置②能测量锌与硫酸的反应速率
C. 装置③能验证铁的吸氧腐蚀
D. 装置④的X电极是负极,则能验证外接电源的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理的利用吸收工业产生的废气CO2、NO2、SO2 等可以减少污染,变废为宝。
(1)用CO2可以生产燃料甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=﹣akJmol﹣1;
2H2(g)+O2(g)═2H2O(l)△H=﹣b kJmol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:
_______________________________________________________。
(2)光气(COCl2)是一种重要化工原料,常用于聚酯类材料的生产,工业上通过Cl2(g)+CO(g)COCl2(g)△H < 0制备。图1为实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:

①0~6min内,反应的平均速率v(Cl2)=_______;
②该反应第一次达平衡时的平衡常数为__________,10min改变的条件是______。
(3)利用氨水可以将SO2和NO2吸收,原理如图2所示:NO2被吸收的离子方程式是___________________________________。

(4)以甲醇燃料电池为电源,粗硅为原料,熔融盐电解法制取硅烷原理如图3,判断A为电源的___极,电解时阳极的电极反应式为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫尔盐的化学式为( NH4)2Fe(SO4)2·6H2O,溶于水而不溶于乙醇,常被用作氧化还原滴定的基准物。下面是制取莫尔盐的部分装置与实验步骤:

①将铁屑放入小烧杯中,加适量的Na2CO3溶液,小火加热几分钟,倒掉溶液后,用蒸馏水洗净铁屑,晾干。
②在锥形瓶中加入2.24 g 铁屑和少量碳粉,由分液漏斗滴加20 mL 3 mol/L硫酸溶液。
③待反应结束后,由分液漏斗加入适量的(NH4)2SO4溶液,过滤。在滤液中加入一定量的乙醇,待晶体析出后,过滤、洗涤、晾干,得莫尔盐晶体。
请回答下列问题:
(1)实验开始前,检查反应器气密性的方法为_____________________。
(2)步骤①中Na2CO3溶液的作用是_____________________________________。
(3)步骤②中滴加硫酸溶液时留取少许溶液于分液漏斗中的原因是__________________,加入少量碳粉的作用是_________________________________________。
(4)步骤③中理论上需加入2 mol/L 的(NH4)2SO4溶液______________mL。
(5)取10.00 g铬青铜样品,将其中的铬氧化为H2CrO4,再加入硫酸酸化,并配成250mL溶液,取出25.00 mL用浓度为0.0180 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,终点时用去标准液20.75 mL。已知弱酸H2CrO4被还原为Cr3+,则滴定时反应的离子方程式为_____________________________________。该样品中铬元素的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂解气主要含有丙烯、1,3-丁二烯等不饱和烃,以它们为原料可合成CR橡胶和医药中间体G,,合成路线如下:

已知:①B、C、D 均能发生银镜反应;
②
(1)A的顺式异构体的结构简式为___________________。
(2)C中含氧官能团的名称是____________,反应①的反应类型为____________________。
(3)写出E→ 反应的化学方程式:_________________________________。
(4)写出同时满足下列条件的医药中间体G的同分异构体的结构简式: __________________。
①与D 互为同系物; ②核磁共振氢谱有三组峰。
(5)用简要语言表述检验B中所含官能团的实验方法:_______________________。
(6)以A为起始原料合成CR橡胶的线路为______________________(其它试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. C![]() CO2
CO2![]() CO
CO![]() CO2
CO2
B. Na2SO3![]() SO2
SO2![]() H2SO3
H2SO3
C. CaCO3![]() CaCl2
CaCl2![]() Ca(ClO)2
Ca(ClO)2
D. N2![]() NO
NO![]() HNO3
HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AJ几种有机物的分子球棍模型或结构简式如图所示,据此回答下列问题:

(1)不能够发生加成反应的烃有__________种,属于芳香族化合物的有_____种。
(2)与E互为同系物的是__________,与G互为同分异构体的是__________。(填字母)
(3)在催化剂作用下,D能与水反应生成乙醛,写出该反应的化学方程式:___________。
(4)上述有机物中有一种能与NaOH溶液反应,请写出该反应的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用软锰矿浆(软锰矿的主要成分是MnO2,还含有硅、铁、铝、钙、镁和少量重金属镍的化合物等杂质)为原料制取电解锰和四氧化三锰。

注:过量的软锰矿将Fe2+氧化为Fe3+。
(1)纤维素[(C6H10O5)n]还原MnO2时,发生反应的化学方程式为_______。
(2)已知:Kp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,加入NH3·H2O后,Al3+浓度为l×10-6mol/L时,溶液中Fe3+浓度为_________
(3)pH对除镍效果的影响如图1:

控制pH为4.5~5.0除镍效果最好,原因是__________
(4)电解MnSO4溶液制备电解锰,用惰性电极电解,阳极的电极反应式为________,为保证电解的顺利进行,电解液必须保持一定的Mn2+浓度。Mn2+浓度和电流效率的关系如图2所示。由图可知当Mn2+浓度大于22g/L时,电流效率随Mn2+浓度增大反而下降,其原因是________。

(5)MnSO4溶液制备四氧化三锰。氨水作沉淀剂,沉淀被空气氧化所得产品的X射线图见图3。
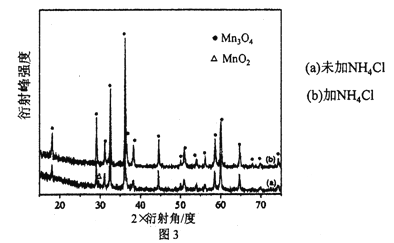
Mn2+形成Mn(OH)2时产生少量Mn2(OH)2SO4,加入NH4Cl会影响Mn2(OH)2SO4的氧化产物,写出NH4Cl存在时,Mn2(OH)2SO4被O2氧化发生反应的离子方程式___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com