
| A、0.9 mol/L |
| B、0.64 mol/L |
| C、0.5 mol/L |
| D、0.32 mol/L |
| n |
| V |
| 0.32mol |
| 0.5L |


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
| A、常温下0.4mol/L HB溶液和0.2mol/L NaOH溶液等体积混合后,则混合后溶液中离子浓度的大小顺序一定为:c(B-)>c(Na+)>c(H+)>c(OH-) |
| B、常温时,pH=2的CH3COOH溶液和pH=12的氨水等体积混合;pH=2的HCl溶液和pH=12的NaOH溶液等体积混合,各混合溶液中由水电离的c(H+)一定相等 |
| C、常温下0.1 mol/L的下列溶液①NH4Al(SO4)2②NH3?H2O ③NH4Cl ④CH3COONH4中,c(NH4+)由大到小的顺序是:①>③>④>② |
| D、0.lmol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、P的非金属性比N强,对应的单质白磷比氮气活泼 |
| B、工业上通常用电解Na、Fe、Cu对应的氯化物制得该三种金属单质 |
| C、氨易液化、硫化氢在同族元素的氢化物中熔沸点最低可用同一原理解释 |
| D、Cl、Br、I的非金属性逐渐减弱,HCl、HBr、HI水溶液的酸性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
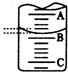 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com