
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
 已知KMnO4、MnO2在酸性条件下均能将草酸 (H2C2O4)氧化:
已知KMnO4、MnO2在酸性条件下均能将草酸 (H2C2O4)氧化:查看答案和解析>>
科目: 来源: 题型:填空题
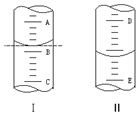 ①如图Ⅰ表示10mL量筒中液面的位置.A与B,B与C刻度间相差1mL,如果刻度A为6,量筒中液体的体积是5.2 mL.
①如图Ⅰ表示10mL量筒中液面的位置.A与B,B与C刻度间相差1mL,如果刻度A为6,量筒中液体的体积是5.2 mL.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 恒温恒容条件下,在工业合成氨反应中,增加氮气的量 | |
| B. | 将稀硫酸改为98%的浓硫酸与Zn反应制取H2 | |
| C. | 在H2SO4与NaOH两溶液反应时,增大压强 | |
| D. | Na与水反应时增大水的用量 |
查看答案和解析>>
科目: 来源: 题型:实验题
 Ca(H2PO2)2(次磷酸钙,一元中强酸H3PO2的钙盐)是一种白色结晶粉末,溶于水(常温时,溶解度16.7g/100g水),其水溶液呈现弱酸性.可用作医药、抗氧化剂以及制备次磷酸钠等.由白磷(P4)与石灰乳制备Ca(H2PO2)2的实验步骤如下:
Ca(H2PO2)2(次磷酸钙,一元中强酸H3PO2的钙盐)是一种白色结晶粉末,溶于水(常温时,溶解度16.7g/100g水),其水溶液呈现弱酸性.可用作医药、抗氧化剂以及制备次磷酸钠等.由白磷(P4)与石灰乳制备Ca(H2PO2)2的实验步骤如下:查看答案和解析>>
科目: 来源: 题型:解答题
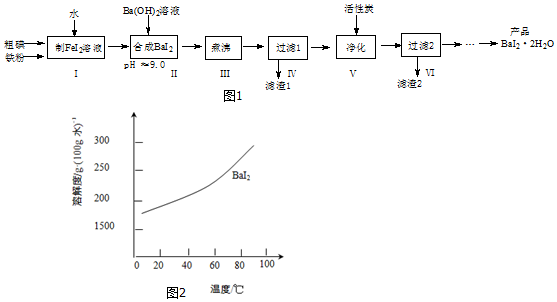
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 加入过量Na2CO3溶液:Na+、Ca2+、NH4+、NO3-、H+ | |
| B. | 加入适量NaHCO3溶液:Na+、Ca2+、NH4+、NO3-、HCO3- | |
| C. | 加入适量NaOH溶液:Na+、Ca2+、NH4+、NO3-、OH- | |
| D. | 加入过量FeSO4和稀硫酸:Fe2+、Fe3+、NH4+、Ca2+、NO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 制取水泥和玻璃的原料中均有纯碱 | |
| B. | 普通玻璃是电的绝缘体,这种透明的固体物质是混合物,无固定的熔点 | |
| C. | 普通玻璃俗称水玻璃 | |
| D. | 硅酸盐工业使用的每一种原料都含有硅 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na在空气中燃烧,发出黄色火焰 | B. | Na在空气中燃烧,产物是Na2O | ||
| C. | Na是银白色金属,硬度小,熔点低 | D. | Na、K合金可作原子反应堆的导热剂 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com