
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫酸 硫酸铜 纯碱 干冰 | B. | 硝酸 硝酸银 熟石灰 干冰 | ||
| C. | 碳酸 纯碱 食盐 冰 | D. | 醋酸 食盐 烧碱 铜 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:推断题
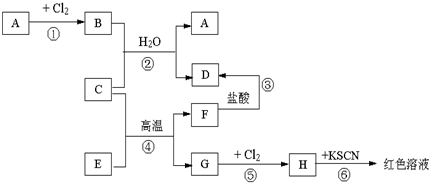
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 400mL | B. | 500mL | C. | 450mL | D. | 无法确定 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应,当SO42-完全沉淀时:H++SO42-+OH-+Ba2+═BaSO4↓+H2O | |
| D. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 离子或分子 | 要 求 |
| A | K+、SO42-、Cl-、HS- | c(K+)<c(SO42-) |
| B | Fe3+、Na+、NO3-、ClO- | 溶液pH=1 |
| C | Na+、Al3+、Cl-、SO42- | 滴加氨水立即有沉淀产生 |
| D | NH4+、Ba2+、NO3-、CH3COOH | 滴加NaOH溶液立即有气泡产生 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
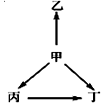 下列各组物质中,甲、乙、丙、丁之间通过一步反应就能实现如图所示变化的是( )
下列各组物质中,甲、乙、丙、丁之间通过一步反应就能实现如图所示变化的是( )| 选项 | 甲 | 乙 | 丙 | 丁 | |
| A | S | SO2 | SO3 | H2SO4 | |
| B | N2 | NH3 | NO | NO2 | |
| C | CuO | Cu | Cu(OH)2 | CuCl2 | |
| D | Al | AlCl3 | NaAlO2 | Al2(SO4)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2 (g)+Cl2(g)═2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 | |
| B. | 2H2(g)+O2 (g)═2H2O(g);△H1 2H2 (g)+O2 (g)═2H2O(l);△H2 | |
| C. | CO(g)+$\frac{1}{2}$ O2(g)═CO2(g);△H1 2CO(g)+O2(g)═2CO2(g);△H2 | |
| D. | S(s)+O2(g)═SO2 (g);△H1 S(g)+O2(g)═SO2 (g);△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com