
科目: 来源: 题型:
【题目】我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应H2S+O2=H2O2+S,已知甲池中发生的反应为

下列说法正确的是( )
A.该装置中电能转化为光能
B.H+从甲池移向乙池
C.甲池中碳棒上发生的电极反应为AQ+2H+-2e-=H2AQ
D.乙池溶液屮发生的反应为H2S+I3-=3I-+S+2H+
查看答案和解析>>
科目: 来源: 题型:
【题目】现有NaHCO3和Na2CO3·xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量)。

(1)A装置的作用是____________________________。
(2)B装置的作用是____________________________。
(3)C装置的作用是___________________________。
(4)若在装置A的试管中装入NaHCO3和Na2CO3·xH2O的混合物3.7 g,用酒精灯加热到反应完全,此时B管增重1.89 g,C管增重0.22 g,则x的值为__________________。
(5)该装置还不是很完善,可能使测定结果偏小,应如何改进________________。为什么?_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量混合气体在密闭容器中发生如下反应:mA(g)+nB(g) ![]() pC(g),达到平衡后,温度不变,将气体体积压缩到1/2,当达到平衡时C的浓度为原来的1.9倍,则下列叙述正确的是( )
pC(g),达到平衡后,温度不变,将气体体积压缩到1/2,当达到平衡时C的浓度为原来的1.9倍,则下列叙述正确的是( )
A. m+n>p B. A的转化率增加
C. 平衡向逆反应方向移动 D. C的体积分数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学——选修5:有机化学基础】化合物A里一种重要的原料,其结构简式为![]() ,可由化合物甲生成。其转化关系及相应反应如下:
,可由化合物甲生成。其转化关系及相应反应如下:

已知:①甲的分子式为C18H17ClO2;
②R1-CHO+R2-OH![]()
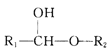
回答下列问题:
(1)A的化学名称为____________;A分子中最多有_________个碳原子处于同一平面上。
(2)C→F的反应类型为___________;F中含氧管能团名称为______________。
(3)化合物甲反应生成A、B的化学方程式为_________________。
(4)A有多种同分异构体,其中符合下列条件:①能与溴发生加成反应;②分子中含苯环,且在 NaOH溶液中发生水解反应;③核磁共振氢进有5组峰,且面积比为1:2:2:1:2的是__________
(写结构简式;立体异构中有一种形式为顺反异构,当相同原子或基团在双键平面同一侧时为顺式结构,在异侧时为反式结构,则A的顺式结构简式为___________。
(5)![]() 是重要的有机合成工业中间体之一,广泛用于医药、香料、塑料和感 光树脂等化工产品,参照上述反应路线,设计一条以A为原料合成
是重要的有机合成工业中间体之一,广泛用于医药、香料、塑料和感 光树脂等化工产品,参照上述反应路线,设计一条以A为原料合成![]() 的路线(其他试剂任选):
的路线(其他试剂任选):
查看答案和解析>>
科目: 来源: 题型:
【题目】aX(g)+bY(g) ![]() cZ(g)+dW(g)在一定容积的密闭容器中反应,5 min时达到平衡,X减少 n mol·L-1,Y减少
cZ(g)+dW(g)在一定容积的密闭容器中反应,5 min时达到平衡,X减少 n mol·L-1,Y减少![]() mol·L-1,Z增加
mol·L-1,Z增加![]() mol·L-1。若将体系压强增大,W的百分含量不发生变化。则化学方程式中各物质的化学计量数之比a∶b∶c∶d应为 ( )
mol·L-1。若将体系压强增大,W的百分含量不发生变化。则化学方程式中各物质的化学计量数之比a∶b∶c∶d应为 ( )
A.3∶1∶2∶1 B.1∶3∶2∶2
C.1∶3∶1∶2 D.3∶1∶2∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】下面三个方法都可以用来制氯气:
①4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②KClO3+6HCl=3Cl2↑+KCl+3H2O
③KMnO4+HCl(浓)—KCl+MnCl2+Cl2↑+H2O(未配平),
根据以上三个反应,回答有关问题:
(1)反应的②的离子方程式为________________。
(2)反应②中,氧化产物与还原产物的质量比为____________。
(3)请将反应③配平:____KMnO4+____HCl(浓)=____KCl十____MnCl2+____Cl2↑+____H2O
(4)若要制得相同质量的氯气,①②③反应中电子转移的数目之比为___________。
(5)已知反应④:4HCl(g)+O2![]() 2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为__________________。
2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙两组同学利用如下两反应(K为25℃时的平衡常数)设计成原电池(装置如图)。
① AsO43—+2I-+2H+![]() AsO33-+I2+H2O K1=14.2
AsO33-+I2+H2O K1=14.2
② 2Fe3++2I-![]() 2Fe2++I2 K2=1.1×108
2Fe2++I2 K2=1.1×108
左池溶液都相同(KI-I2溶液),右池溶液不同:甲组为Na3AsO4和Na3AsO3的混合溶液,乙组为FeCl3和FeCl2的混合溶液。

当电流表指针指向零点后再改变右池的条件,改变的条件及电流表指针偏转情况记录如下:
操作 | 电流表指针偏转情况 | |
甲组 | 若滴加浓盐酸 | 偏向左方 |
若滴加浓NaOH溶液 | 偏向右方 | |
乙组 | 若滴加浓FeCl2溶液 | 不偏转 |
若滴加浓FeCl3溶液 | 偏向左方 |
则下列叙述错误的是( )
A.同温同浓度时,氧化性:Fe3+>AsO43—
B.与反应②比较,反应①平衡常数小,可逆程度大
C.左池中滴加淀粉溶液变蓝色,再加入足量FeCl2固体,蓝色会褪去
D.甲组在右池加入浓NaOH溶液,此时石墨Ⅱ为负极,AsO33—被氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度。
(1)若将W g Na2C2O4配成100mL标准溶液,移取20.00mL置于锥形瓶中,则酸性KMnO4溶液应装在______(填“酸式”或“碱式”)滴定管中,判断滴定达到终点的现象是_________________。
(2)写出KMnO4与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2的化学方程式:________________________。
(3)25℃时,用pH计测得0.10 mol·L-1草酸钠溶液的pH=a,则H2C2O4的第二级电离平衡常数Ka2= 。
(4)CaC2O4是难溶于水的固体,受热易分解,在一定温度下向2L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生反应: CaC2O4(s)![]() CaO(s)+CO(g)+CO2(g),若前5min内生成CaO的质量为16.8g,则该段时间内υ(CO)=__________mol·L-1·s-1;当反应达到平衡后,将容器体积压缩到原来的一半,则下列说法正确的是__________(填答案选项编号)。
CaO(s)+CO(g)+CO2(g),若前5min内生成CaO的质量为16.8g,则该段时间内υ(CO)=__________mol·L-1·s-1;当反应达到平衡后,将容器体积压缩到原来的一半,则下列说法正确的是__________(填答案选项编号)。
A.平衡不移动,CaO的质量不变
B.平衡发生移动,当CO的百分含量不变时达到新的平衡
C.平衡发生移动,但CO和CO2的浓度都没有改变
D.平衡向逆反应方向移动,且该反应的化学平衡常数减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com