
科目: 来源: 题型:
【题目】在陶瓷器皿表面的釉质中含有极微量的Pb、Cd、Sb等有毒金属盐类,为防止中毒,不能长期盛放下列物质的是( )
A. 食盐 B. 酱油
C. 蔗糖 D. 食醋
查看答案和解析>>
科目: 来源: 题型:
【题目】将0.96 g铜片加入500 mL0.2 mol/L稀硝酸中,充分反应,现欲使溶液中的Cu2+全部转化为Cu(OH)2沉淀,应加入0.2 mol/L NaOH溶液体积为( )
A. 300 mL B. 400 mL C. 450 mL D. 500 mL
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
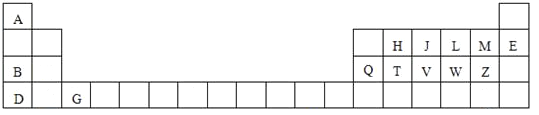
(1)原子半径最大的元素是 _____;在化合物中只有负价的元素是 ______;属于副族元素是____;适合作半导体材料的是____,(只用表中的字母填写)
(2)V在周期表中的位置第____周期第______族.
(3)A与M元素形成的化合物是______化合物,D与Z原子形成的化学键是____键;
(4)J、H、T三种元素的最高价含氧酸的酸性由强到弱的顺序是___________________________________;(用化学式表示)
(5)L元素形成的氢化物的在-4℃时是__________晶体(填晶体类型),其密度比对应的液态还小,呈固体而非气体的原因是____________________________________。
(6)写出B、Q两种元素的氧化物对应的水化物相互反应的化学方程式_________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】测定平衡常数对定量认识化学反应具有重要意义。已知:I2能与 I-反应生成 I3-,并在溶液中建立如下平衡: I2+I-![]() I3-。通过测平衡体系中 c(I2)、 c(I-)和 c(I3-),就可求得该反应的平衡常数。
I3-。通过测平衡体系中 c(I2)、 c(I-)和 c(I3-),就可求得该反应的平衡常数。
Ⅰ.某同学为测定上述平衡体系中 c(I2),采用如下方法:取 V1 mL 平衡混合溶液,用cmol·L-1的Na2S2O3溶液进行滴定(反应为 I2+2Na2S2O3=2NaI+Na2S4O6),消耗 V2 mL 的Na2S2O3溶液。根据V1、V2和c可求得c(I2)。
(1)上述滴定时,可采用________做指示剂,滴定终点的现象是_____________________。
(2)下列对该同学设计方案的分析,正确的是________(填字母)。
A.方案可行。能准确测定溶液中的 c(I2)
B.不可行。因为 I-能与 Na2S2O3发生反应
C.不可行。只能测得溶液中 c(I2)与 c(I3-)之和
Ⅱ.化学兴趣小组对上述方案进行改进,拟采用下述方法来测定该反应的平衡常数(室温条件下进行,溶液体积变化忽略不计):

已知: ①I-和 I3-不溶于 CCl4; ②一定温度下, 碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即![]() 是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
(3)操作Ⅰ使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是________(填名称)。试指出该操作中应注意的事项为________。 (任写一条)
(4)上述测定过程均正常操作,下层液体中碘单质的物质的量浓度是________;若终点读数时俯视滴定管, 则会造成所测浓度________ (填“等于”、 “大于”或“小于”)该值。
(5)实验测得上层溶液中 c(I3-)=0.0049 mol·L-1,结合上述有关数据,计算室温条件下反应 I2+I-![]() I3-的平衡常数 K=________(用具体数据列出计算式即可)。
I3-的平衡常数 K=________(用具体数据列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求完成下列填空:
(1)![]() 、
、![]() 、
、![]() 互为______,16O2、18O3互为______。
互为______,16O2、18O3互为______。
A.同位素 B.相同物质
C.同素异形体 D.同分异构体
(2)写出下列物质的电子式:
①MgCl2______;②NaOH______;
(3)写出下列物质的结构式:
①C2H2_______;②H2O________;
(4)已知拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是 ( )
A.摩尔是表示物质量的单位,每摩尔物质含有6.02×1023个分子
B.1mol氧的质量为16
C.0.5molHe约含有6.02×1023个电子
D.2H既可表示2个氢原子又可表示2mol氢原子
查看答案和解析>>
科目: 来源: 题型:
【题目】Fe3+、SO42-、Al3+和X四种离子以物质的量之比2:4:1:1大量共存于同一溶液中,X可能是
A.Na+ B.OH– C.CO32- D.Cl–
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中Cl-的物质的量最多的是( )
A.200mL 2mol/L MgCl2溶液
B.150mL 5mol/L KClO3溶液
C.标准状况下,13.44L的HCl气体
D.29.25gNaCl固体
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,容积为2 L的恒容密闭容器中,通入2 mol N2、3 mol H2进行反应N2(g)+3H2(g) ![]() 2NH3(g),20 min后,N2的物质的量为1.9 mol,1 h后测得容器内气体的压强不再改变,且为反应开始时压强的0.8倍,则下列叙述正确的是:
2NH3(g),20 min后,N2的物质的量为1.9 mol,1 h后测得容器内气体的压强不再改变,且为反应开始时压强的0.8倍,则下列叙述正确的是:
A.当容器内压强不改变时,说明反应已达到平衡状态
B.增加H2的浓度或降低温度,平衡将向正反应方向移动,且反应速率均加快
C.前20 min用NH3表示的反应速率为0.01 mol·L-1·min-1
D.1 h后反应进行完全,容器中的N2浓度为0.55 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com