
科目: 来源: 题型:
【题目】在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22:9,当1.6克X与Y完全反应后,生成4.4克R,则在此反应中Y和M的质量之比为( )
A.16:9
B.23:9
C.32:9
D.46:9
查看答案和解析>>
科目: 来源: 题型:
【题目】水合肼(N2H4·H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂。利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaC1O=Na2CO3+N2H4·H2O+NaCl
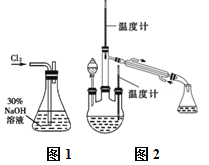
实验一:制备NaClO溶液。(实验装置如图1所示)
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有______(填标号)。
A.玻璃棒 B.烧杯 C.烧瓶 D.容量瓶 E.胶头滴管
(2)锥形瓶中发生反应的离子方程式是___________________。
实验二:制取水合肼。(实验装置如图2所示)
(3)①仪器A的名称为_______________。
②反应过程中需控制反应温度,同时将分液漏斗中溶液缓慢滴入A中,如果滴速过快则会导致产品产率降低,同时产生大量氮气,写出该过程的化学反应方程式:__________,故分液漏斗中的溶液是______(填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO
③充分反应后,加热蒸馏A内的溶液,收集108~114℃馏分,即可得到水合肼的粗产品。
实验三:测定馏分中肼含量。
(4)称取馏分5.0g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加23滴淀粉溶液,用0.10mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定时,碘的标准溶液盛放在______(填"酸式”或“碱式”)滴定管中,本实验滴定终点的现象为____________________。
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质重分数为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态Cl原子核外电子占有的原子轨道数为______个,P、S、Cl的第一电离能由大到小顺序为_______。
(2)PCl3分子中的中心原子杂化轨道类型是______,该分子构型为_______。
(3)PH4Cl的电子式为______,Ni与CO能形成配合物Ni(CO)4,该分子中π键与σ键个数比为________。
⑷己知MgO与NiO的晶体结构(如图1)相同,其中Mg2+和Ni2+的离子半径分别为66 Pm和 69 pm,则熔点:MgO___NiO(填“>”、“<”或“=”),理由是______。
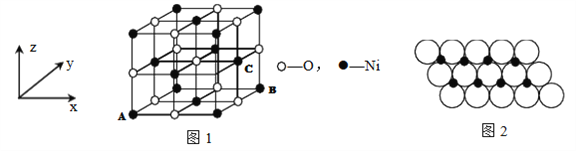
(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为______。
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列, Mi2+填充其中(如图2),己知O2-的半径为a m,每平方米面积上分散的该晶体的质量为____g。(用a、NA表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学实验小组设计如图装置制备干燥纯净的氯气,并验证氯气的性质。
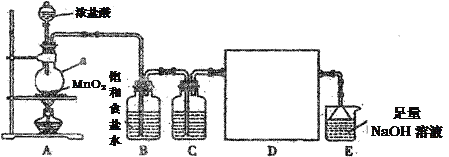
(1)仪器a的名称是____________________。
(2)B装置中试剂的作用是________________,C装置中的试剂为________________。
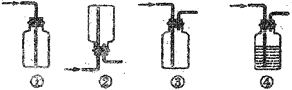
(3)D处方框内氯气的收集装置可选用____________(填写序号)。
(4)将氯气通入如图装置中,充分反应后,静置,观察到的现象为________________;分离反应产物的实验操作名称为____________,需要的玻璃仪器有____________________。
(5)实验结束后,E装置中氯元素的存在形式除了ClO-外,还有________(填写离子符号),请设计实验证明该离子的存在:____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与社会、生产、生活密切相关.下列说法正确的是( )
A.柠檬属于酸性食物
B.油脂是人类维持生命活动所需能量的主要来源
C.PM2.5是指空气中氮氧化物和硫氧化物含量之和
D.登高山时防晒是为了防止强紫外线引起皮肤蛋白质被灼伤变性
查看答案和解析>>
科目: 来源: 题型:
【题目】不能与溴水发生反应的是
①苯 ②乙烯 ③亚硫酸 ④NaOH溶液 ⑤AgNO3溶液 ⑥裂化汽油 ⑦甲烷 ⑧镁粉
A.① B.①⑦ C.①⑦⑧ D.①②⑤⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)材料是人类赖以生存和发展的重要物质基础。
①水泥是最常用的建筑材料,它属于__________(填字母)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
②下列硅酸盐产品的生产原料中不需要石灰石的是__________(填字母)。
a.陶瓷 b.水泥 c.玻璃
③高岭土是烧制瓷器的重要原料,其组成可以表示为Al2Si2Ox(OH)y,其中x,y的数值分别是__________(填字母)。
a.5、4 b.6、3 c.7、2
④下列物品的构成材料中主要是合成高分子材料的是__________(填字母)。
a.宣纸 b.羊毛衫 c.保鲜膜
⑤橡胶是制造轮胎的主要原料,天然橡胶是__________结构(填“线型”或“体型”),需经过硫化处理改变其结构,增强其机械强度。
(2)良好的生态环境可以提升生活质量。
①汽车尾气(含有烃类、CO、NOx、SO2等)是城市空气的主要污染源,治理方法之一是在汽车排气管上加装“催化转化器”使CO、NOx转化为无害物质,下列说法不正确的是__________。
a.CO和NOx反应的化学方程式为:2xCO+2NOx![]() 2xCO2+N2
2xCO2+N2
b.上述方法增加了空气中CO2的含量,加重了酸雨污染
c.在日光照射下,汽车尾气还会产生光化学烟雾
②家庭装修中使用的装潢材料缓慢释放出来的污染物达一定浓度时会影响人体健康,下列属于常见装修污染物的是_________(填字母)。
a.NO、NO2 b.甲醛、苯 c.SO2、CO
③通过水质检测确定水体中污染物的种类和浓度后,可采取不同的方法对污水进行处理。例如向废水中通入臭氧,运用_______(填字母)除去其中含有的油类、氰化物。
a.中和法 b.沉淀法 c.氧化法
④天然水中含有细小悬浮颗粒物可以用明矾进行处理,明矾溶于水后电离出的铝离子与水反应生成氢氧化铝胶体能吸附悬浮颗粒物,写出铝离子与水反应的离子方程式____________。
(3)均衡营养、合理用药是保证人体健康的重要途径。
①葡萄糖可作为营养剂供给人体能量,其在人体内发生的主要反应是______(填字母)。
a.加成反应 b.水解反应 c.氧化反应
②维生素C能防治坏血病,可通过食用富含它的食物进行补充,碱性条件下维生素C易被空气氧化,为减少维生素C的损失,烹调食物时可加入少许 ______(填字母)。
a.白糖 b.食醋 c.苏打
③人体内有8种氨基酸必须通过食物摄入,某品牌蛋糕中含有下列物质,其中水解生成氨基酸的是____ (填字母)。
a.纤维素 b.蛋白质 c.油脂
④“胃舒平”又名复方氢氧化铝,除主要成分氢氧化铝外,还含有一定量的三硅酸镁(2MgO·3SiO2·nH2O),三硅酸镁与胃酸发生反应生成MgCl2和H2SiO3,其反应方程式是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】近几年我国大面积发生雾霾天气,其主要原因是SO2、NOx,挥发性有机物等发生二次转化,研究碳、氮、硫及其化合物的转化对于环境的改善有重大意义。
(1)在一定条件下,CH4可与NOx反应除去NOx,已知有下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g)△H=+67.0 kJ·mol-1
2NO2(g)△H=+67.0 kJ·mol-1
③H2O(g)=H2O(l)△H=-41.0 kJ·mol-1
则CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g)△H=_____kJ·mol-1;
CO2(g)+2H2O(g)+N2(g)△H=_____kJ·mol-1;
(2)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图一所示,电极材料为石墨。
① a表示_____离子交换膜(填“阴”或“阳”)。A—E分别代表生产中的原料或产品。其中C为硫酸,则A表示_______。
②阳极的电极反应式为____________________。
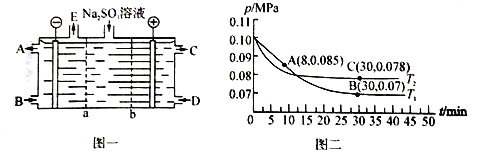
(3)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为: 2SO2(g)+O2(g) ![]() 2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],测得容器内总压强与反应时间如图二所示。
2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],测得容器内总压强与反应时间如图二所示。
①图中A点时,SO2的转化率为________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率v0(正)与A点的逆反应速率vA(逆)的大小关系为v0(正)_____vA(逆) (填“>"、“<”或“ = ”)。
③图中B点的压强平衡常数Kp=______。(Kp=压强平衡常数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)为了清除NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理。现有由a mol NO、b molNO2、c molN2O4组成的混合气体恰好被VL氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质和条件己略去)。A是由两种元素组成的难溶于水的物质,摩尔质量为88 g·mol-l;B是常见的强酸;C是一种气态氢化物;气体E能使带火星的木条复燃;F是最常见的无色液体;无色气体G能使品红溶液褪色;向含有I的溶液中滴加KSCN试剂,溶液出现血红色。请回答下列问题:

(1)G的化学式为_________________________。
(2)C的电子式为________________________。
(3)写出反应①的离子方程式:_____________________。
(4)写出反应②的化学方程式:__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作能达到实验目的是( )
A.用排饱和氯化铵溶液的方法收集氨气
B.用重结晶的方法除去BaSO4固体中混有的NaCl
C.将碳酸钙置于蒸发皿中高温灼烧可得到氧化钙
D.将硫酸铜溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到胆矾晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com