
科目: 来源: 题型:
【题目】韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视。一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示。下列说法正确的是

A. N极为电源负极,联氨从c口通入
B. 负极上每消耗lmol N2H4,转移6mol电子
C. 正极的电极反应式为:O2+2H2O+4e-==4OH-
D. 可将联氨改进为引火性低、稳定性好的N2H4·H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温条件下,可逆反应H2(g)+I2( g)2HI(g)在体积固定的密闭容器中进行,达到平衡的标志是( )
A. 混合气体的颜色不再改变B. H2、I2、HI分子个数比为1:1:2
C. 混合气体中I2和H2的体积分数相等D. 混合气体的压强不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A. 氯气可用于药物的合成
B. 钠和钾合金在常温下是液体,可用于快中子反应堆作热交换剂
C. 硫酸铜可用于饮用水消毒
D. 生物质能来源于植物及其加工产品所贮存的能量
查看答案和解析>>
科目: 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,《本草纲目》中有如下记载:“(火药)乃焰消(KNO3)、硫黄、杉木炭所合,以为烽燧铳机诸药者”,其中利用的KNO3的性质是
A. 自燃性 B. 易分解 C. 还原性 D. 氧化性
查看答案和解析>>
科目: 来源: 题型:
【题目】电镀产生的工业废水含有的重金属离子(Cu2+、Ni2+等)和CN形成难以除去的络合物,用电解法制备高铁酸钠(Na2FeO4)处理废水是目前比较先进的方法。已知氰化氢有毒易挥发。电解装置如图所示,下列选项正确的是( )
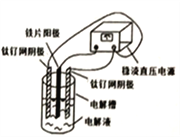
A. 铁片连接电源的负极
B. 电解时,每生成lmolFeO42-,转移电子3mol
C. CN被氧化成CO2和N2,Cu2+、Ni2+形成难溶碱而除去
D. 已知HFeO4-的氧化性比FeO42-更强,故pH<7时处理废水效率更高
查看答案和解析>>
科目: 来源: 题型:
【题目】某工业废料料中含有Cr(OH)3、Al2O3、CuO、NiO等物质,工业上通过下列流程回收其中有用的金属和制取Na2Cr2O7。
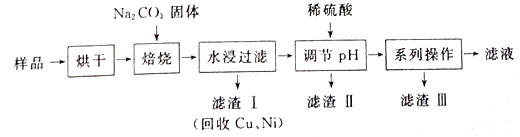
已知:
①“水浸过滤”后的溶液中存在Na2CrO4、NaAlO2等物质
②除去滤渣II后,溶液中存在反应2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
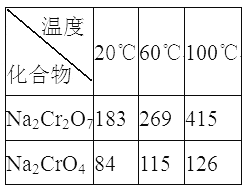
③Na2Cr2O7、Na2CrO4在不同温度下的溶解度(g/100 g H2O)如下表:
(1)“焙烧”过程中生成NaAlO2化学方程式为_____________________。
(2)生成滤渣II时,需加入适量稀硫酸调节溶液的pH除去A1O2-。若稀硫酸过量,则因过量引起反应的离子方程式为______________________。
(3)“系列操作”为:继续加入稀硫酸、_____、冷却结晶、过滤。继续加入稀硫酸的目的是_____________,滤渣III的主要成分是_________(填化学式)。
(4)工业上还可以在“水浸过滤’’后的溶液中加人适量稀硫酸,用石墨作电极电解生产金属铬,阴极的电极反应式为______________。
(5)流程图最后的“滤液”中仍然有残留的Na2Cr2O7。Cr为重金属元素,若含量过高就排入河流中,会对河水造成重金属污染。为测定“滤液”中的c(Na2Cr2O7),某实验小组取“滤液”20mL,水稀释至250 mL,再取稀释后的溶液25 mL于锥形瓶中,用c mol L-1的FeSO4溶液进行氧化还原滴定,到终点时消耗FeSO4溶液体积为V mL[已知发生的反应为Na2Cr2O7 + FeSO4 + H2 SO4![]() Na2SO4+ Cr2(SO4) 3 + Fe2(SO4)3 + H2O(未配平)],则“滤液”中的(Na2Cr2O7)=______mol·L-1。
Na2SO4+ Cr2(SO4) 3 + Fe2(SO4)3 + H2O(未配平)],则“滤液”中的(Na2Cr2O7)=______mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中既属于化合反应,又属于氧化还原反应的是( )
A. SO2+H2O2=H2SO4B. Zn+2AgNO3=Zn(NO3) 2+2Ag
C. 2HClO=2HCl+O2↑D. CO2+2NaOH=Na2CO3+H2 O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关原子轨道的叙述中正确的
A. 氢原子的2s轨道能量较3p能级高
B. 锂原子的2s与5s 轨道皆为球形分布
C. p能级的原子轨道呈纺锤形,随着能层序数的增加,p能级原子轨道也在增多
D. 能层n=4的原子轨道最多可容纳16个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是乙酸乙酯的合成路线图,已知B的水溶液可以溶解CaCO3,E可作果实催熟剂。
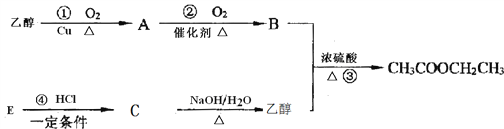
请完成下列问题:
(1)A的名称是_______;B中所含的官能团是__________;E的结构简式为___________________ 。
(2)反应③的反应类型是________;反应④的反应类型是_________________。
(3)写出CH3COOCH2CH3的同分异构体(含有酯基)______________________。
(4)请写出以下反应化学方程式:
A、合成路线①的方程式为____________________;
B、成路线④的方程式为_____________________;
C、物质E在一定条件下发生加聚反应的化学反应方程为___________________________;
D、写出乙酸乙酯在NaOH溶液中的水解反应方程式______________________;
E、写出B的水溶液溶解CaCO3的方程式________________________。
(5)如果用4.6 g的乙醇和9.0 g的B反应制得乙酸乙酯5.28 g。则本实验的产率是:__________(产率指的是某种生成物的实际产量与理论产量的比值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表所示实验,现象和结论均正确的是( )
选项 | 实验 | 现象 | 结论 |
A | 向浓度均为0.lmol·L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
B | 常温下,测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH值 | 前者的 pH值比后者的大 | 非金属性:S>C |
C | 向某溶液中滴加足量盐酸 | 溶液中出现了气泡和淡黄色浑浊 | 溶液中含有S2-和 SO32- |
D | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3 +KSCN |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com