
科目: 来源: 题型:
【题目】有机化学(选修模块)乙酸苯甲酯是制造香精的原料之一,其合成路线如下:

(1)乙酸苯甲酯的分子式为____________,反应Ⅰ的反应类型为____________。
(2)A的结构简式为_____________,B中含有的官能团的名称为______________。
(3)反应Ⅲ的化学方程式为_________________________________。
(4)![]() 不能发生的化学反应是___________(填序号)。
不能发生的化学反应是___________(填序号)。
a.取代反应 b.消去反应 c.加成反应
(5)C属于芳香族化合物的同分异构体的结构简式为___________(写出一种即可)。
(6)反应Ⅳ的化学方程式为_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用氟碳铈矿(主要成分CeCO3F)提取CeCl3的一种工艺流程如下:
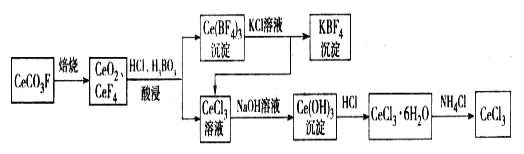
请回答下列问题:
(1)CeCO3F中,Ce元素的化合价为_________。
(2)酸浸过程中可用稀硫酸和H2O2替换HCl,优点为____________;写出稀硫酸、H2O2与CeO2反应的离子方程式:______________。
(3)写出Ce(BF4)3中加入KCl溶液反应的离子方程式:__________。
(4)化学家研究发现,SbF5能将MnF4从离子[SbF6]2-的盐反应得到,SbF5转化成稳定离子[SbF6]-的盐。而SbF4很不稳定,受热易分解为SbF3和F2。根据据以上研究写出以K2MnF6和SbF5为原料,在 423 K 的温度下制备F2的化学方程式:______________________。
现代工业以电解熔融的氟氢化钾(KHF2)和氟化氢(HF)混合物制备氟单质,电解制氟装置如图所示。 已知KHF2是一种酸式盐,写出阴极上发生的电极反应式_______。电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是________。
(5)已知25 ℃时,HF的电离平衡常数Ka=3.6×10-4,CaF2的溶解积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol/L HF溶液中加入 1 L 0.2 mol/L CaCl2 溶液,通过列式计算说明是否有沉淀产生:______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、对N2(g)+3H2(g)![]() 2NH3(g) ΔH<0反应,其他条件不变情况下,改变起始氢气物质的量(用n(H2)表示),实验结果如下如图表示(图中T表示温度,n表示物质的量);
2NH3(g) ΔH<0反应,其他条件不变情况下,改变起始氢气物质的量(用n(H2)表示),实验结果如下如图表示(图中T表示温度,n表示物质的量);

(1)比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是______.
(2)若容器容积为1L,n=5mol,T2条件下反应达到平衡时H2的转化率为60%,则且H2与N2物质的量之比为1:1,则在起始时体系中加入N2的物质的量为______mol,反应的平衡常数K=______.
Ⅱ、煤制天然气的工艺流程如图所示:

(3)反应Ⅰ:C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH=+135kJ/mol,
CO(g)+H2(g) ΔH=+135kJ/mol,
①通入的氧气会与部分碳发生燃烧反应。请利用能量转化及配合移动原理说明通入氧气的作用:_______。
②若反应Ⅰ在体积不变的密闭容器中进行,下列能说明反应Ⅰ达到平衡状态的是________。
a.压强不变 b.气体密度不变 c.气体平均摩尔质量不变 d.氢气浓度不变
(4)反应Ⅱ:C0(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-41kJ/mol。如图3表示不同温度条件下,煤气化反应Ⅰ发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
CO2(g)+H2(g) ΔH=-41kJ/mol。如图3表示不同温度条件下,煤气化反应Ⅰ发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
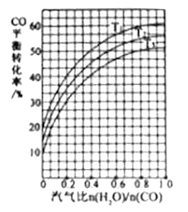
①判断T1、T2和T3的大小关系:________。(从小到大的顺序)
②若煤气化反应Ⅰ发生后的汽气比为0.8,经煤气化反应Ⅰ和水气变换反应Ⅱ后,得到CO与H2的物质的量之比为1:3,则反应Ⅱ应选择的温度是_________(填“T1”或“T2”或“T3”)。
(5)实验室模拟甲烷化反应:一定条件下,向体积为2L的恒容密闭容器中充入1.2molCH4(g)和4.8molCO2(g),发生反应CH4(g)+3CO2(g) ![]() 2H2O(g)+4CO(g) ΔH>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,20s内v(CH4)=______,此反应的ΔH =_____。
2H2O(g)+4CO(g) ΔH>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,20s内v(CH4)=______,此反应的ΔH =_____。

查看答案和解析>>
科目: 来源: 题型:
【题目】下图是一种常用的学习用品——圆规的材料组成:

(1)圆规含有的金属单质是___________(填化学式),请写出它在氧气中燃烧的化学方程式____________。
(2)这些材料中属于有机合成材料的是_________(填序号)。
(3)铅笔芯的主要成分是_________,请写出它的另一种用途_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】日本福岛核电站泄漏的核燃料衰变产物有放射性元素![]() 、
、![]() 等,其中
等,其中![]() 是个双刃剑,医院可以用它来治疗甲状腺癌;但是如果没有癌症,它也可能诱发甲状腺癌。下列有关说法中不正确的是
是个双刃剑,医院可以用它来治疗甲状腺癌;但是如果没有癌症,它也可能诱发甲状腺癌。下列有关说法中不正确的是
A. 碘131I原子核所含中子数是78
B. 核能的利用证实原子的可分性
C. 碘127I原子和放射性碘原子131I属于同位素
D. 碘127I原子和碘131I原子的质子数不同
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)我省拥有非常丰富的海洋资源,合理开发利用海洋资源,造福海南人民。
①目前国际上“海水淡化”的主要方法有______________________ (任写一种);
②我省著名的莺歌海盐场是重要的海水晒盐基地。海水晒盐的原理是海水受热使水分 _________ ,当NaCl达到其饱和浓度时,以固态形式析出;
③海水经过处理后获得的饱和食盐水可以通过_________ 法制得NaOH、Cl2和H2等重要的化工原料;
④从氯碱工业的副产品中能够得到一种含氯消毒剂,有效成分为NaClO,该消毒剂起作用的原理是利用了NaClO的__________(填“强氧化性”或“强还原性”)。
(2)合成氨是重要的化学工业之一,其部分生产工艺如下图所示

请回答下列问题:
①操作Ⅰ的名称是______。
a.蒸馏 b.过滤 c.干馏
②合成氨反应中催化剂的主要作用是________________________ ;
③从合成塔中出来的气体除了NH3之外,还有_________________ (写化学式);
④合成氨工业中,操作Ⅱ的工艺称为“循环操作”,使用该工艺的好处是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质性质、用途的说法都正确的是
A. 硅晶体是良好的半导体,可用于制造光导纤维
B. 高压钠灯发出的黄光透雾能力强,可用于道路和广场照明
C. 生石灰能与水反应,可用于除去CO2气体中少量的水蒸气
D. 碳酸钠具有碱性,可用于治胃酸中和剂
查看答案和解析>>
科目: 来源: 题型:
【题目】录音磁带是在醋酸纤维、聚酯纤维等纤维制成的片基上均匀涂上一层磁性材料——磁粉制成的。制取该磁粉的主要物质是
A. FeO B. Fe2O3 C. Fe3O4 D. Al2O3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列比较不正确的是
A. 气态氢化物稳定性HF>HCl>HBr>HI
B. 熔点Rb>K>Na>Li
C. 碱性RbOH>KOH>NaOH>LiOH
D. 还原性Na>Mg>Al
查看答案和解析>>
科目: 来源: 题型:
【题目】已知氧化性Br2>Fe3+>I2,向含有Fe2+、Br-、I-各0.1 mol 的溶液中通入Cl2。通入Cl2的体积(标准状况)与溶液中某种离子(用Q表示)的物质的量的关系如下图所示,下列说法中正确的是( )

A. Q是I-
B. Q是Br-
C. b点时溶液中阴离子只有Cl-(不考虑OH-)
D. ab区间的反应:2Fe2++Cl2===2Fe3++2Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com