
科目: 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
mCeO2![]() (mx)CeO2·xCe+xO2
(mx)CeO2·xCe+xO2
(mx)CeO2·xCe+xH2O+xCO2![]() mCeO2+xH2+xCO
mCeO2+xH2+xCO

下列说法不正确的是
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.图中ΔH1=ΔH2+ΔH3
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH2e![]()
![]() +2H2O
+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】NaClO2的漂白能力是漂白粉的4~5倍, NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:

(1)ClO2发生器中的反应为:2NaClO3+SO2+H2SO4===2ClO2+2NaHSO4。实际工业生产中,可用硫黄、浓硫酸代替原料中的SO2,其原因为__________________(用化学方程式表示)。
(2)反应结束后,向ClO2发生器中通入一定量空气的目的:________________________。
(3)吸收器中生成NaClO2的离子反应方程式为________________________________。
(4)某化学兴趣小组用如下图所示装置制备SO2并探究SO2与Na2O2的反应:
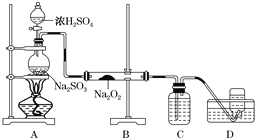
①盛放浓H2SO4仪器名称为____________。
②D中收集到的气体可使带余烬的木条复燃,B中发生的反应可能为__________________、Na2O2+SO2===Na2SO4。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)常温下,将20.0 g 14%的NaCl溶液跟30.0 g 24%的NaCl溶液混合,混合后得到密度为1.17 g·cm-3的溶液。请计算:
①混合后的溶液中NaCl的质量分数为__________________。
②混合后的溶液的物质的量浓度为___________。
③在1 000g水中需加入__________ mol氯化钠,才能使其浓度恰好与上述混合后的溶液的浓度相等(计算结果保留1位小数)。
(2)相同条件下,某Cl2与O2混合气体100 mL恰好与150 mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为__________,混合气体的平均相对分子质量为____________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为____________。
(4)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为____________ (计算结果保留1位小数) 。若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为_______________ (计算结果保留1位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO和联氨(N2H4)的性质及应用的研究是能源开发、环境保护的重要课题。
(1)①用CO、O2和KOH溶液可以制成碱性燃料电池,则该电池反应的离子方程式为________________。
②用CO、O2和固体电解质还可以制成如下图1所示的燃料电池,则电极d的电极反应式为______________。
(2)联氨的性质类似于氨气,将联氨通入CuO浊液中,有关物质的转化如图2所示。
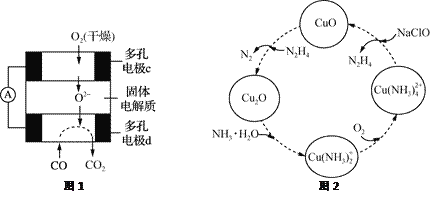
①在图示2的转化中,化合价不变的元素是_________(填元素名称)。
②在转化过程中通入氧气发生反应后,溶液的pH将________(填“增大”、“减小”或“不变”)。转化中当有1 mol N2H4参与反应时,需要消耗O2的物质的量为________。
③加入NaClO时发生的反应为:Cu(NH3)![]() +2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
+2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
该反应需在80℃以上进行,其目的除了加快反应速率外,还有________、________
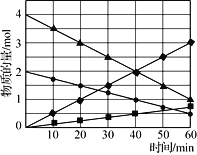
图3
(3)CO与SO2在铝矾土作催化剂、773 K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图3所示,写出该反应的化学方程式:____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关石油和煤的叙述中,不正确的是
A. 煤的干馏属于化学变化
B. 石油分馏得到的汽油是混合物
C. 煤的气化和液化是物理变化
D. 石油裂化和裂解可以得到乙烯、丙烯等重要基本化工原料
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应A+3B=2C+D来说,下列反应速率中最快的是()
A. v(A)=0.3mol·L-1·min-1 B. v(B)=0.6mol·L-1·min-1
C. v(C)=0.5mol·L-1·min-1 D. v(D)=0.001mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于物质性质变化的比较,不正确的是( )
A. 酸性强弱:HIO4>HBrO4>HClO4 B. 原子半径大小:Na>S>O
C. 碱性强弱:KOH>NaOH>LiOH D. 金属性强弱:Na>Mg>Al
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如图4所示:
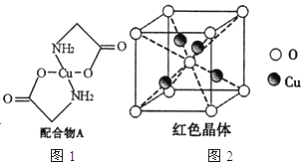
(1)Cu元素基态原子的外围电子排布式为______________。
(2)元素C、N、O的第一电离能由大到小排列顺序为_______________。
(3)配合物A中碳原子的轨道杂化类型为_______________________。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有![]() 键的数目为____________mol。
键的数目为____________mol。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:____________(写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图2所示,则该化合物的化学式是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】配制500 mL0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为____________。(精确到0.1g)
(2)有以下仪器:①烧杯 ②100ml量筒 ③1000ml容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码) ⑦滴定管
(Ⅰ)配制时,必须使用的仪器有_____(填代号),还缺少的仪器是__;
(Ⅱ)实验两次用到玻璃棒,其作用分别是:______________、_____________。
(Ⅲ)配制时,一般可分为以下几个步骤:①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为_______________
(3)某学生实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是_______。
A.使用滤纸称量氢氧化钠固体
B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤
D.胶头滴管加水定容时俯视刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com