
科目: 来源: 题型:
【题目】已知:MnO2+4HCl![]() MnCl2+Cl2↑+2H2O,一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成4.48L氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(所设反应前后体积不变),请计算:
MnCl2+Cl2↑+2H2O,一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成4.48L氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(所设反应前后体积不变),请计算:
(1)反应耗用MnO2的质量;(2)被氧化的HCl物质的量;(3)跟浓盐酸的物质的量浓度。
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
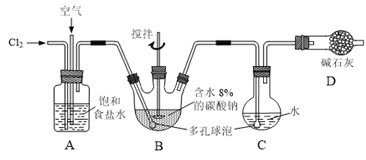
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气体积比的方法是______。
②为使反应充分进行,实验中采取的措施有______。
(2)①写出装置B中产生Cl2O的化学方程式并用单线桥法标出电子转移的方向和数目:______。
②若B无冷却装置,则进入C中的Cl2O会大量减少。其原因是______。
(3)装置C中采用棕色圆底烧瓶是因为______。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用酸式滴定管准确量取20.00 mL次氯酸溶液,______。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。除常用仪器外须使用的仪器有:电子天平,真空干燥箱)
查看答案和解析>>
科目: 来源: 题型:
【题目】《本草纲目》记载了民间酿酒的工艺:“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……”在实验室中模拟上述过程,用到的仪器是
A. 蒸馏烧瓶 B. 蒸发皿 C. 球形冷凝管 D. 分液漏斗
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组性质比较错误的是
A. 氢化物的热稳定性:H2S>HCl B. 酸性:HClO4>H2SO4
C. 碱性: Mg(OH)2>Al(OH)3 D. 原子半径Cl>F
查看答案和解析>>
科目: 来源: 题型:
【题目】《本草经集注》中记载了区别硝石(KNO3)和朴消(Na2SO4):“以火烧之,紫青烟起,乃真硝石也”, 这是运用了硝石的
A. 焰色反应 B. 氧化性 C. 还原性 D. 不稳定性
查看答案和解析>>
科目: 来源: 题型:
【题目】下列属于固氮反应的是( )
A. 2NO+O2→2NO2 B. 3NO2+H2O→2HNO3+NO
C. NH3+HCl→NH4Cl D. N2+3Mg→Mg3N2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,浓硫酸既表现强氧化性,又表现酸性的是( )
A. 浓硫酸与氧化亚铁反应 B. 浓硫酸与木炭粉反应
C. 浓硫酸与氧化铜反应 D. 浓硫酸与氯化钠固体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中错误的是( )
A. 消除散落在地面的汞珠的方法是撒上硫粉
B. 铜丝擦亮后伸入硫蒸气中产物是CuS
C. 可以用CS2浸泡的方法除去附在玻璃器皿上的硫
D. 可以用加热浓NaOH溶液的方法除去附在试管内壁上的硫
查看答案和解析>>
科目: 来源: 题型:
【题目】某班在实验室进行制取乙酸乙酯的分组实验,主要步骤如下:
①按下图连接好装置,并检查装置的气密性。

②在试管A中加入3 mL乙醇,然后边振荡试管边慢慢加入2 mL浓硫酸和2 mL乙酸,再加入沸石。然后用酒精灯缓慢加热.
③待试管B中收集到一定量产物后停止加热,撤出试管B,振荡后静置。
相对分子质量 | 密度/(gcm-3) | 熔点/℃ | 沸点/℃ | 水中溶解性 | |
乙醇 | 46 | 0.789 | -117.3 | 78.5 | 以任意比互溶 |
乙酸 | 60 | 1.050 | 16.6 | 117.9 | 易溶 |
乙酸乙酯 | 88 | 0.897 | -84 | 77 | 难溶 |
回答下列问题:
(1)反应的化学方程式为______________。
(2)两组同学想要比较所制得的乙酸乙酯的产量,简便的方法是__________。
(3)该反应为可逆反应,要提高乙酸乙酯的产率,该实验中采取的措施有_________。
(4)现对全班同学试管B中的液体集中处理,得到乙酸乙酯的粗产品并回收乙醇,需进行的操作名称是__________。
(5)用下图所示装置验证:乙酸的酸性比碳酸强,碳酸的酸性比苯酚强。
装置中所装的药品分别是:甲_________,乙________,丙____________。试管中观察到的现象是________。

查看答案和解析>>
科目: 来源: 题型:
【题目】氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成都需要用氯气。
I.工业上通常采用电解法制氯气:观察图1,回答:

(1)电解反应的化学方程式为___________________。
(2)若饱和食盐水中通电后,b侧产生的气体检验方法是____________。
Ⅱ.某学生设计如图2所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题:
(1)在A装置中用固体二氧化锰与浓盐酸,在加热条件下制取氯气,写出反应的化学方程式_____________;
(2)漂白粉将在U形管中产生,其化学方程式是____________。
(3)C装置的作用是_______________。
(4)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是____。
②试判断另一个副反应(用化学方程式表示)____,为避免此副反应的发生,可将装置做何改进_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com