
科目: 来源: 题型:
【题目】为了探究三种气态氧化物(SO2、NO2、CO2)的性质,某同学设计了一组实验:
实验一:探究三种气体在水中的溶解性,用三支相同的试管收集满三种气体,倒置在盛满水的烧杯中,一段时间后,观察到的试管中液面高度如图A、B、C所示.
(1)在相同条件下,三种气体在水中溶解度最大的是 , 写出A烧杯中发生反应的化学方程式: .
(2)实验二:用三只集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中.分别缓慢通入适量O2或Cl2 , 如图D、E、F所示.一段时间后,D、E装置的集气瓶中充满溶液,F装置的集气瓶中还有气体剩余.
实验二中装置D的集气瓶最终充满溶液(假设瓶内液体不扩散):
①写出装置D中总反应的化学方程式: ,
②假设该实验条件下,气体摩尔体积为a L/mol,则装置D的集气瓶中所得溶液溶质的物质的量浓度为
(3)实验前在F装置的水槽里滴加几滴紫色石蕊试液,观察到的现象是 , 通入氧气后,可能观察到的实验现象是溶液颜色加深,写出反应的化学方程式:
(4)写出E装置的溶液充满集气瓶时,有关反应的离子方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式,正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为 CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2与H2的混合气体5g,在150℃时和足量的氧气混合,用电火花充分引燃,在相同状况下再将反应后所得混合气体通入到足量的Na2O2中,测得Na2O2固体增重的质量为3.4g,则原混合气体中CO2的质量分数为( )
A. 25% B. 75% C. 88% D. 32%
查看答案和解析>>
科目: 来源: 题型:
【题目】Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g) H=+11 kJ·mol-1。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g) H=+11 kJ·mol-1。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当改变条件,再次达到平衡时,下列有关叙述不正确的是
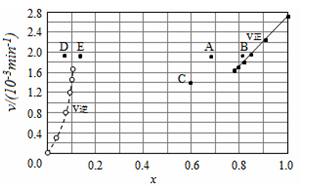
A.若升高温度到某一温度,再次达到平衡时,相应点可能分别是A、E
B.若再次充入a mol HI,则达到平衡时,相应点的横坐标值不变,纵坐标值增大
C.若改变的条件是增大压强,再次达到平衡时,相应点与改变条件前相同
D.若改变的条件是使用催化剂,再次达到平衡时,相应点与改变条件前不同
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列有关叙述正确的是( )
A. 标况下,11.2L氟化氢中含有的分子数目为0.5NA
B. 室温下,21.0g乙烯和丁烯的混合气体中所含的碳原子数目是NA
C. 室温下,2L 0.05mol/L的NH4NO3溶液中所含有的氮原子数目是0.2NA
D. 22.4L Cl2与足量NaOH溶液反应时转移的电子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】铜有两种常见的氧化物CuO和Cu2O。某学习小组取0.98g(用精密天平测量)Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图1所示:另外,某同学绘制了三条表示金属氧化物与其所含金属元素的质量的关系曲线,如图2所示。则下列分析正确的是( )

A. 图1中,a到b的过程中有0.01 mol电子发生了转移
B. 图1整个过程中共生成0.26 g水
C. 图2三条曲线中,表示CuO和其所含Cu元素质量关系的曲线是A
D. 图1中A和B化学式分别为Cu2O和CuO
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关蛋白质结构、功能多样性的说法正确的是
A. 蛋白质结构的多样性与构成蛋白质的氨基酸的种类、数目和空间结构有关
B. 已知某化合物含有C、H、O、N等元素,可以推断此物质一定为蛋白质
C. 不同蛋白质分子中组成肽键的化学元素无差异性
D. 蛋白质空间结构改变,可能会导致蛋白质失去生物活性,但这种改变都是可逆的
查看答案和解析>>
科目: 来源: 题型:
【题目】T℃时,体积均为0.5L的两个恒容密闭容器中发生可逆反应:2A(g)+B(g) ![]() 2C(g)△H=-QkJ/mol(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如下表:
2C(g)△H=-QkJ/mol(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如下表:
容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
A | B | C | ||
① | 2 | 1 | 0 | 放热 0.75QkJ |
② | 0.4 | 0.2 | 1.6 | |
下列叙述中正确的是( )
A. 容器①、②中反应的平衡常数均为4
B. 容器②中达到平衡时放出的热量为0.05QkJ
C. 向容器①中通入氦气,平衡时A的转化率不变
D. 其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于2/3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com