
科目: 来源: 题型:
【题目】下列说法正确的是 ( )
A. 澄清石灰水可用来鉴别Na2CO3和NaHCO3溶液
B. 能使湿润的碘化钾淀粉试纸变蓝的物质不一定是氯气
C. 常温下浓硝酸和稀硝酸均可用铁质容器盛装
D. 浓硫酸有氧化性,稀硫酸没有氧化性
查看答案和解析>>
科目: 来源: 题型:
【题目】有下列10种物质:①苯酚,②乙酸,③牛油,④丙氨酸,⑤乙酸乙酯,⑥溴水,⑦甲醛,⑧苛性钠溶液,⑨氯化铁溶液,⑩金属钠。前5种物质中的1种跟后5种物质均能反应;后5种物质中的1种跟前5种物质均能反应,则这两种物质分别是( )
A. ①⑥ B. ③⑩ C. ①⑧ D. ②⑨
查看答案和解析>>
科目: 来源: 题型:
【题目】磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
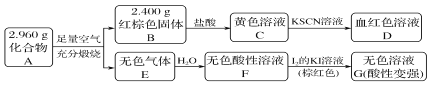
请回答:
(1)A的组成元素为________(用元素符号表示),化学式为_____________________。
(2)溶液C可溶解铜片,例举该反应的一个实际应用________。
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),该气体分子的电子式为________。写出该反应的离子方程式____________________。
写出F→G反应的化学方程式___________________________________。
设计实验方案探究溶液G中的主要微粒(不考虑H2O、H+、K+、I-) _____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】灰锡结构松散,不能用于制造器皿;而白锡结构坚固,可以制造器皿。己知0℃、101 kPa时Sn(白,s)=Sn(灰,s)△H= -2180.9 J·mol-1,△S=- 6.61 J·mol-1·K-1。假设△H和△S不随温度的改变而改变,现把白锡制造的器皿放在室温下存放,它会不会变成灰锡而不能继续使用 ( )
A. 会变 B. 不会变 C. 不能确定 D. 升高温度才会变
查看答案和解析>>
科目: 来源: 题型:
【题目】在使用容量瓶配制溶液时,下列操作正确的是( )
A. 使用容量瓶前必须检查容量瓶是否漏水 B. 容量瓶用蒸馏水洗净后,再用待配溶液润洗
C. 称好的固体试样需用纸条小心地送入容量瓶中 D. 摇匀后发现凹液面下降,再加水至刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】为了探索外界条件对反应X(g)+Y(?)![]() cZ(g)的影响,以X和Y物质的量之比为1:1开始反应,通过实验得到不同条件下平衡时Z的体积分数,实验结果如图所示。下列判断正确的是
cZ(g)的影响,以X和Y物质的量之比为1:1开始反应,通过实验得到不同条件下平衡时Z的体积分数,实验结果如图所示。下列判断正确的是
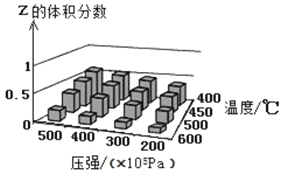
A. △H>0 c<2
B. 400℃、4×l07Pa下,该反应达平衡时X的体积分数是25%
C. Y可以是气体也可以是非气体
D. 反应物的转化率随压强增大而减小
查看答案和解析>>
科目: 来源: 题型:
【题目】将BaO2放入密闭真空容器中,反应2BaO2(s)![]() 2BaO(s)+O2(g)达到平衡。下列哪些改变可使平衡移动,且新平衡时氧气的浓度与原平衡不同 ( )
2BaO(s)+O2(g)达到平衡。下列哪些改变可使平衡移动,且新平衡时氧气的浓度与原平衡不同 ( )
A. 保持体积和温度不变,充入一定量的氧气 B. 保持温度不变,缩小容器的体积
C. 保持体积不变,升高温度 D. 保持体积和温度不变,加入BaO2
查看答案和解析>>
科目: 来源: 题型:
【题目】SO2属于严重大气污染物,不能直接排放在空气中,其两种处理方法如下:

已知:①25℃时,NH3·H2O的电离平衡常数Kb=1.8×10-5。
②相关物质的Ksp数据如下表所示。

请回答下列问题:
(1)方法1工艺中利用了SO2的______________(填化学性质)。用过氧化氢也能氧化NH4HSO3溶液为铵盐溶液,过氧化氢电子式为__________________,将所得铵盐溶液变为无水铵盐的方法为__________。
(2)方法2生产工艺的优点有________________________________________。
(3)方法2中为检验分离器的分离效果,取分离后的H2SO4溶液于试管中,向其中逐滴加入AgNO3溶液至充分反应,若观察到___________________,证明分离效果较好。
(4)某含有大量氯化银沉淀的悬浊液中c(Cl-)=0.36 mol·L-1,加入等体积的溴化钠溶液,若要产生溴化银沉淀,加入的溴化钠溶液的最小浓度是____________mol·L-1。
(5)氨水是一种重要的弱电解质,常温下,向0.1 mol/L氨水中加入少许NH4NO3,使溶液中c(NH3·H2O):c(NH4+)=5 :9,此时溶液的pH=_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX和3molY发生反应:X(s)+mY(g)![]() 3Z(g),平衡时,Y、Z的体积分数分别为60%、40%,在此平衡体系中加入2mol Z(g),再次达到平衡后,Y、Z的体积分数不变。下列叙述不正确的是 ( )
3Z(g),平衡时,Y、Z的体积分数分别为60%、40%,在此平衡体系中加入2mol Z(g),再次达到平衡后,Y、Z的体积分数不变。下列叙述不正确的是 ( )
A. 从向平衡体系中加入2mol Z(g)到重新达到平衡始终存在v(逆)>v(正)
B. 两次平衡的平衡常数相同
C. 第二次平衡时,Z的浓度为2mol·L-1
D. m=3
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学兴趣小组同学为探究二氧化氮的氧化性和还原性,设计了如下装置:
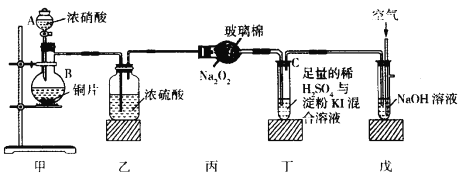
已知:2NO2+2NaOH=NaNO2+NaNO3+H2O NO2+NO+2NaOH=2NaNO2+H2O
请回答下列问题:
(1)盛放浓硝酸装置的名称是____________________________。
(2)装置乙的作用是______________________________________。
(3)装置丙中的实验现象为淡黄色固体变为白色,其反应为Na2O2+2NO2![]() 2NaNO3,该实验证明NO2具有_________________性。
2NaNO3,该实验证明NO2具有_________________性。
(4)丁装置证明NO2具有氧化性,其实验现象为________________________________,反应的化学方程式为__________________________________________。
(5)装置戊中通入空气的目的为_______________________________________。
(6)若要证明装置丁的试管C中发生反应后的某种产物具有氧化性,你的实验设计方案为_________。
(7)该小组同学用酸性KMnO4溶液可测定反应后装置戊中NaNO2的含量(其他物质不与反应)。用___________(填写“酸式”或“碱式”)滴定管取amol/L酸性KMnO4溶液滴定装置戊中反应后的溶液V2mL,消耗酸性KMnO4溶液V1mL,则反应后装置戊中NaNO2的含量为__________g/mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com