
科目: 来源: 题型:
【题目】某学习小组设计如下实验装置进行NH3的催化氧化实验。
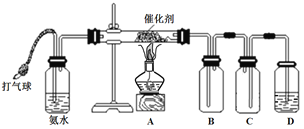
请填写下列空白:
(1)该实验所用的氨水的质量分数为15%,密度为0.94gmL-1,则该氨水的物质的量浓度为___________。实验室配制该物质的量浓度氨水的过程中玻璃棒的作用有_____________ 。
(2)连接好装置后,在D中装入少量水浸没导管口,轻轻向装置中鼓入空气。表示装置气密性良好的现象是________________________________。
(3)实验进行一段时间后,B中出现红棕色。移去酒精灯,催化剂继续保持红热。
①催化剂保持红热的原因是______________________________________。
②氨催化氧化的化学方程式为____________________________________。
(4)加快鼓气速度时,B中会出现白烟。白烟的成分是_________(填化学式)
(5)为获得纯净的NO2,可在装置A与B之间连接____________。
a.盛有碱石灰的干燥管 b.盛有浓硫酸的洗气瓶 c.盛有无水CaCl2的洗气瓶
(6)该实验说明氨的性质有__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )

A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外小组利用废旧铝铜合金(含有少量杂质铁)制备Al(OH)3,流程如下:

回答下列问题:
(1)铝铜合金很坚硬,轻而抗张强度大,可代替昂贵的铜线为电线。但该合金暴露在空气中易被腐蚀,原因是___________________________。
(2)废旧铝铜用过量的稀硫酸浸取时,发生反应的化学方程式为________________。
(3)能溶解滤渣A而不产生空气污染的方法是___________________。
(4)在温度为358~368K时,加入Al2O3调节pH=1.6~1.8,析出黄铁矾[Na2Fe6(SO4)4(OH)12]。写出析出黄铁矾的离子方程式
(5)加NH3·H2O后将沉淀经过滤、_________、_________称量,得Al(OH)3质量为废旧铝铜合金质量的2.6 倍,则废旧铝铜合金含中Al的质量分数≤________%。
(6)Al(OH)3是塑料和有机聚合物的一种理想的阻燃剂填充料。塑料或聚合物与外部热源接触而燃烧时,可分为以下几个阶段:①加热,②分解,③起火,④燃烧,⑤蔓延。Al(OH)3阻燃起作用的阶段是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A. 水的电离程度始终增大
B. ![]() 先增大再减小
先增大再减小
C. c(CH3COOH)与c(CH3COO-)之和始终保持不变
D. 当加入氨水的体积为10 mL时,c (NH4+)=c(CH3COO-)
查看答案和解析>>
科目: 来源: 题型:
【题目】
钒及其化合物在科学研究中和工业生产中具有许多用途。
(1)基态钒原子的核外价电子排布式为________。
(2)钒有+2、+3、+4、+5等几种化合价。这几种价态中,最稳定的是______。
(3)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。例举与VO43-空间构型相同的一种阳离子__________(填化学式)。
(4)钒(Ⅱ)的配离子有[V(CN)6]4-、[V(H2O)6]2+等。
①CN-与N2互为等电子体,CN-中σ键和Π键数目比为________。
②对H2O与V2+形成[V(H2O)6]2+过程的描述不合理的是______________。
a.氧原子的杂化类型发生了变化
b.微粒的化学性质发生了改变
c.微粒中氢氧键(H-O)的夹角发生了改变。
d.H2O与V2+之间通过范德华力相结合。
③在[V(H2O)6]2+中存在的化学键有___________。
a.金属键 b.配位键 c. σ键 d.Π键 f. 氢键
(5)已知单质钒的晶胞如图,则V原子的配位数是_______,假设晶胞的边长为d nm,密度ρ g·cm-3,则钒的相对原子质量为_______________。(设阿伏伽德罗常数为NA)

查看答案和解析>>
科目: 来源: 题型:
【题目】已知M2O7x- + 3 S2- + 14 H+ = 2 M 3+ + 3S ↓ + 7H2O,则M2O7x-中的M的化合价为( )
A. +2 B. +3 C. +4 D. +6
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关盐类水解的叙述中正确的是( )
A. 溶液呈中性的盐一定是强酸、强碱生成的盐
B. 含有弱酸根盐的水溶液一定呈碱性
C. 盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱
D. 强酸强碱盐的水溶液一定呈中性
查看答案和解析>>
科目: 来源: 题型:
【题目】SO2是我国大部分地区雾霾天气产生的主要原因之一。加大SO2的处理力度,是治理环境污染的当务之急。SO2主要来自于汽车尾气、燃煤烟气、硫酸工业尾气、冶金工业烟气等。
(1)“催化转换器”能将汽车尾气中CO与NO转化成可参与大气生态环境循环的无毒气体,并促进烃类充分燃烧及SO2的转化,但也在一定程度上提高了空气的酸度。“催化转换器”提高空气酸度的原因是_____________________________。
(2)用氨水将燃煤烟气中的SO2转化成NH4HSO3。该法是利用了SO2________(填选项字母编号)
A.漂白性 B.氧化性 C.还原性 D.酸性氧化物性质
(3)用生物质热解气(主要成分CO、CH4、H2)将燃煤烟气中SO2在高温下还原成单质硫。主要发生了下列反应:
2H2(g) +SO2(g)= S(g) + 2H2O(g) △H1 = + 90.4kJmol-1
2CO(g) +O2(g)= 2CO2(g) △H2 = - 566.0kJmol-1
S(g) +O2(g)= SO2(g) △H3 = - 574.0kJmol-1
试写出CO将SO2还原成S(g)的热化学方程式__________________________。
(4)将硫酸工业尾气中的SO2转化成硫酸,同时获得电能。装置如图所示(电极均为惰性材料):
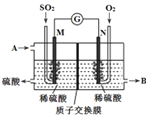
①溶液中的H+移向_______。(填“M”或“N”)
②M极发生的电极反应式为________________。
③写出A、B所代表的物质的化学式:
A_______、B ________。
(5)利用硫酸钠溶液吸收冶金工业烟气中SO2,再用惰性电极电解,能获得所需的产品,装置如图所示。
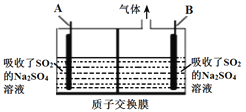
①若电解后A极区得到硫酸,则B电极反应式为________________________。
②若电解后A极区析出硫磺,则电解反应的化学方程式为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质。下列说法正确的是
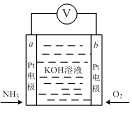
A. 电化学气敏传感器工作时,c(K+)保持不变
B. 电化学气敏传感器工作时,电子流向a→b→a
C. 当外电路通过0.15 mol电子时,反应消耗的NH3为0.05mol
D. 电极a反应式为:2NH3 + 6e﹣+ 6OH﹣= N2↑+ 6H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】在-50℃时,液氨的电离跟水的电离相似,存在平衡:2NH3(l)![]() NH4++NH2-,NH4+的平衡浓度为1×10-15mol·L-1,下列说法错误的是
NH4++NH2-,NH4+的平衡浓度为1×10-15mol·L-1,下列说法错误的是
A. 在液氨中加入NaNH2,可使液氨的离子积变大
B. 此温度下液氨的离子积K为1×10-30
C. 在液氨中加入NH4Cl,液氨的离子积不变
D. 改变温度,液氨中c(NH4+)=c(NH2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com