
科目: 来源: 题型:
【题目】某物质的结构式如下:
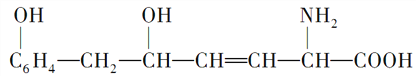 ,
,
下列叙述中不正确的是( )
A. 1mol该物质最多可与1molH2加成
B. 1mol该物质最多可与2mol NaOH完全反应
C. 该物质可与醇发生酯化反应,也可与酸发生酯化反应
D. 该物质既能与碱反应,又能与盐酸反应,也能与氯化氢反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,正确的是( )
A.气象环境报告中新增的“PM2.5”是对一种新分子的描述
B.“光化学烟雾”“硝酸型酸雨”的形成都与氮氧化合物有关
C.小苏打是制作面包等糕点的膨松剂,苏打是治疗胃酸过多的一种药剂
D.乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的
查看答案和解析>>
科目: 来源: 题型:
【题目】在80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应: N2O4![]() 2NO2 ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
n/mol时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0.20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20s-40s内用N2O4表示的平均反应速率为_______mol/(L·s)
(2)计算在80℃时该反应的平衡常数K=_______;
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色______ (填“变浅”、“变深”或“不变”) ;
(4)要增大该反应的K值,可采取的措施有______ (填序号)
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(5)下列物质中: ①属于非电解质的是_____。②属于强电解质的是_____。
A.NaOH溶液 B.Cu C.液态HCl D.液态CH3COOH E.蔗糖溶液 F.液氨 G.氨水H.CuSO4晶体 I.石墨 J.无水乙醇
查看答案和解析>>
科目: 来源: 题型:
【题目】随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放显减少10%,二氧化碳(CO2)的排放量也要大幅减少。
(1)在恒温,容积为1L恒容中,硫可以发生如下较化,其反应过程和能量关系如图1所示(已知:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
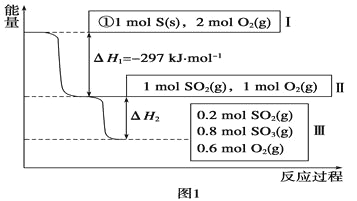
①写出能表示硫的燃烧热的热化学方程式:_________。,
②ΔH2=_________kJ·mol-1。
③在相同条件下,充入1molSO3和0.5mol的O2,则达到平衡时SO3的转化率为_______;此时该反应______(填“放出“或“吸收”)_______kJ的能量。
(2)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下40%~50%。
①CO2可转化成有机物实现碳循环。在休积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。从3min到9min,v(H2)=_______mol/(L·min)
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。从3min到9min,v(H2)=_______mol/(L·min)
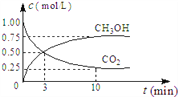
②为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有_______ (填编号)。
A.升高温度 B.缩小容器体积 C.再充入CO2气体 D.使用合适的催化剂
(3)工业上,CH3OH也可由CO2和H2合成。参考合成反应CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数。下列说法正确的是______________。
CH3OH(g)的平衡常数。下列说法正确的是______________。
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=___kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H=___kJ·mol-1。
(2)下列措施中,能提高CH3OCH3产率的有___。
A.使用过量的CO B.升高温度 C.增大压强
(3)以下说法能说明反应3H2(g)+3CO(g) ![]() CH3OCH3(g)+CO2(g) 达到平衡状态的有______。
CH3OCH3(g)+CO2(g) 达到平衡状态的有______。
A.H2和CO2的浓度之比为3:1
B.单位时间内断裂3个H-H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(4)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应: C(s)+CO2(g) ![]() 2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:
2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。
①该反应H_____0(填“>”、“<”或“=”),550℃时,平衡后若充入惰性气体,平衡_____(填“正移”、“逆移“或“不移动" )。
②)650℃时,反应达平衡后CO2的转化率为_____(保留2位有效数字)。
③T℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=_____P总.
查看答案和解析>>
科目: 来源: 题型:
【题目】把0.6molX气体和0.4molY气体混合于容积为2L的容器中,使其发生如下反应:3X(g)+Y(g)nZ(g)+2W(g).2min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.1mol/( Lmin),则n的值为( )
A.4
B.3
C.2
D.1
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,甲、乙、丙分别表示在不同条件下,可逆反应A(g)+B(g) ![]() xC(g)的生成物C的百分含量w(C)和反应时间(t)的关系。
xC(g)的生成物C的百分含量w(C)和反应时间(t)的关系。

(1)若甲中两条曲线分别代表有催化剂和无催化剂的情况,则____曲线代表无催化剂时的情况。
(2)若乙图表示反应达到平衡后分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入惰性气体后的情况.则_____ 曲线表示恒温恒容的情况,此时混合气体中w(C) _____(填“变大”、“变小”或“不变”)。
(3)根据丙图可以判断该可逆反应的正反应是_____(填“放热”或“吸热”)反应.x的值为____。
(4)丁图表示在某固定容器的密闭容器中,上述可逆反应达到平衡后,某物理量随着温度(T)的变化情况,根据你的理解,丁的纵坐标可以是_______(填序号)。
①w(C) ②A的转化率 ③B的转化率 ④压强 ⑤c(A) ⑥c(B)升高温度,平衡向________(填“正反应”或“逆反应”)方向移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com