
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 2.4 g镁原子变成离子时,失去的电子数为0.3NA
B. 常温常压下,28 g氮气所含的原子数为2NA
C. 18 g H218O中含有的原子总数为3NA
D. 32 g氧气和4 g氦气所含原子数目相等,均为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学反应2AB+D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如表所示,表中温度为摄氏度(℃).
实验 | 浓度 时间 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | c1 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | T3 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,回答下列问题:
(1)在实验1中,以反应物A浓度的变化表示该反应在0~10min内的平均反应速率为
(2)在实验1中,c1数值为
(3)在实验1、2中有一个实验使用了正催化剂.判断是实验(选填“1”或“2”)使用了正催化剂.
(4)在实验1、3中反应温度不同.判断T3800(选填“<”或“>”).
查看答案和解析>>
科目: 来源: 题型:
【题目】(1) 写出镍原子的电子排布式_____________。
(2) 丙酮(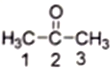 )分子中2号碳原子的杂化方式为__________;与CS2互为等电子体的阴离子是__________(写一种)。
)分子中2号碳原子的杂化方式为__________;与CS2互为等电子体的阴离子是__________(写一种)。
(3)含0.1mol[Cr(H2O)Cl]Cl2·H2O的水溶液与足量硝酸银溶液反应生成_______molAgCl沉淀。H2O分子的键角比H2S分子的键角大,原因是_______ 。
(4) 由铜与氯形成的一种化合物的晶胞结构如图所示(黑点代表铜原子)。

①该晶体的化学式为_______。
②将晶胞内的4个黑点相互连接所形成的立体构型是_______。
③晶体中与一个氯原子距离最近的氯原子有_______个。
④已知该晶体的密度为ρg.cm-3,阿伏加德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为_______pm(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生产、生活密切相关,下列有关说法正确的是
A.葡萄糖注射液能产生丁达尔效应
B.高纯度的硅单质广泛用于制作光导纤维
C.二氧化硫的大量排放是造成光化学烟雾的主要原因
D.汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下反应2AB(g)![]() A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A. 单位时间内生成nmolA2,同时消耗2n molAB
B. 容器内,3种气体AB、A2、B2共存
C. AB的消耗速率等于A2的消耗速率
D. 容器中各组分的体积分数不随时间变化
查看答案和解析>>
科目: 来源: 题型:
【题目】有关材料用途的说法中不正确的是( )。
A.氧化铝陶瓷可用作高压钠灯的灯管
B.氮化硅陶瓷可用作陶瓷发动机的材料
C.光导纤维可用作遥测遥控、照明等
D.氧化铝陶瓷可用作半导体材料
查看答案和解析>>
科目: 来源: 题型:
【题目】为解决能源短缺问题,工业生产中应合理利用化学能。
(1)25℃,1.01×105Pa时,实验测得,4g氢气在O2中完全燃烧生成液态水,放出572KJ的热量,则表示H2的燃烧热的热化学方程式为_________
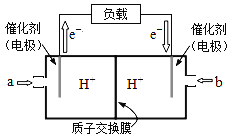
(2)如图是某笔记本电脑使用的甲醇燃料电池的结构示意图放电时甲醇应从____处通入(填“a”或“b”).电池内部H+向______(填“左”或“右”)移动。写出电池负极的电极反应式_____。
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.已知:N2(g)+3H2(g)=2NH3(g)ΔH=-93kJ/mol,试根据表中所列键能数据计算a的数值__________。
化学键 | H-H | N-H | N≡N |
键能/kJmol | 436 | a | 945 |
当可逆反应中净生成N-H物质的量为2mol时,反应放热________
(4) 已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJmol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJmol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJmol-1
根据盖斯定律,计算反应2C(s,石墨)+H2(g)=C2H2(g)的△H=___.
查看答案和解析>>
科目: 来源: 题型:
【题目】100mL 0.1mol/L盐酸与50mL 0.2mol/L 氨水混合,在所得溶液中( )
A. c(Cl-)>c(NH4+)> c(OH-)> c(H+) B. c(Cl-)=c(NH4+)> c(OH-)= c(H+)
C. c(H+)+c(Cl-)=c(NH4+)+ c(OH-)+2c(NH3.H2O) D. c(H+)+ c(NH4+)=c(Cl-)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y、Z、W是短周期中原子序数依次增大的4种主族元素.X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;元素Y 的原子最外层电子数是其内层的3倍;Z元素+2价阳离子的核外电子排布与氖原子相同;W的单质常温常压下为气态. 回答下列问题:
(1)元素W在周期表中位于第周期,第族.
(2)从空气中获得的X元素单质的电子式:
(3)比较Y与Z形成的简单(单原子)离子的半径相对大小:(用离子符号表示).
(4)管道工人曾经用X的氢化物检验W单质是否泄漏.W单质能将X从其气态氢化物中置换出来.试写出该反应的化学方程式:;W单质泄漏时出现的现象是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com