
科目: 来源: 题型:
【题目】下列说法不正确的是
A.加热鸡蛋、肉类,可使其中的蛋质变性
B.碳酸氢钠、氢氧化铝可用于治疗胃酸过多:
C.将海水中钢闸门连接电源负极可防止其被腐蚀
D.明矾[KAl(SO4)2·12H2O]用于净水是因为它有氧化性
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液含以下离子Na+、Mg2+、Ba2+、SO42-、I-、CO32-中的一种或几种,除水电离产生的H+、OH-外不含其他离子。为确定其组成进行以下实验,分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是( )
A.Na+B.SO42-
C.Ba2+D.Mg2+
查看答案和解析>>
科目: 来源: 题型:
【题目】已知实验室制氢气的反应:Zn+2HCl=ZnCl2+H2↑.现用13.0gZn粉与一定量2mol/L稀盐酸充分反应,一段时间后Zn粉无剩余.
(1)用双线桥或单线桥标出电子转移的方向和数目
(2)比较H+和Zn2+氧化性强弱
(3)消耗盐酸的体积至少为多少升?
(4)生成ZnCl2的物质的量为多少?
(5)标准状况下,最多能收集到多少升气体?
(6)反应中转移的电子的个数.
查看答案和解析>>
科目: 来源: 题型:
【题目】如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( ) 
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.Y的氢化物的沸点比H2O的沸点高
D.Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是
A. 如果存放有钠、电石等危险化学品的仓库着火,消防员不能用水灭火,应用泡沫灭火器灭火
B. 用石英制成光导纤维,由水玻璃制硅胶都是化学变化
C. 利用油脂在碱性条件下的水解,可以制得肥皂和甘油
D. 糖类、油脂、蛋白质都是高分子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( ) 
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.Y的氢化物的沸点比H2O的沸点高
D.Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是关于反应A2(g)+3B2(g)2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( ) 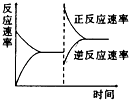
A.升高温度,同时加压
B.降低温度,同时减压
C.增大反应物浓度,同时减小生成物浓度
D.增大反应物浓度,同时使用催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】硼及其化合物在工业上有许多用途.以铁硼矿(主要成分为Mg2B2O5H2O,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示: 
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、4.9、9.7和12.4.
回答下列问题:
(1)为提高“浸出”速率,除适当增加硫酸浓度外,还可采取的措施有;
(2)实验室中过滤操作所需要的玻璃仪器有:玻璃棒、;
(3)“浸渣”中的物质是(化学式);
(4)“净化除杂”需先加H2O2溶液,作用是 , 然后再调节溶液的pH约为5,目的是;
(5)“粗硼酸”中的主要杂质是(填名称);
(6)单质硼可用于生产具有优良抗冲击性能的硼钢.以硼酸和金属镁为原料在加热条件下可制备单质硼, 用化学方程式表示制备过程
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:
药品名称 | 熔点/℃ | 沸点(℃) | 密度g/cm3 | 溶解性 |
丁醇 | ﹣89.5 | 117.7 | 0.8098 | 微溶于水、溶于浓硫酸 |
1﹣溴丁烷 | ﹣112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |
根据题意完成填空:
(一)制备1﹣溴丁烷粗产品:在下图装置的圆底烧瓶中依次加入NaBr,10mL正丁醇,2粒沸石,分批加入1:1的硫酸溶液,摇匀,加热30min.化学方程式:NaBr+H2SO4+CH3CH2CH2CH2OH→CH3CH2CH2CH2Br+NaHSO4+H2O
(1)图1反应装置中加入沸石的目的是 . 配制体积比为1:1的硫酸所用的定量仪器为(选填编号) a.天平 b.量筒 c.容量瓶 d.滴定管
(2)冷凝管的进水方向为 , 这样选择的原因是 .
(3)图2装置中,能代替上图中最后收集装置的是(填序号).
(4)若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是选填编号). a.蒸馏 b.氢氧化钠溶液洗涤 c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
(5)(二)制备精品:将得到的粗1﹣溴丁烷依次用浓硫酸、水、10% 碳酸钠、水洗涤后加入无水氯化钙进行干燥,然后再将1﹣溴丁烷按图3装置蒸馏. 收集产品时,控制的温度应在℃ 左右;
(6)实验制得的1﹣溴丁烷的质量为10.895g,则正丁醇的产率为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.实验室需要0.1molL﹣1NaOH溶液500mL.根据溶液的配制情况回答下列问题.
(1)在如图所示仪器中,配制上述溶液肯定不需要的是(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 . 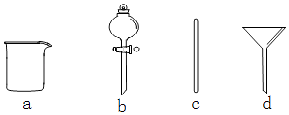
(2)配制时,其正确的操作顺序是(用字母表示,每个操作只用一次) .
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1cm~2cm处
(3)实验两次用到玻璃棒,其作用分别是:先用于、后用于 .
(4)关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水.这些叙述中正确的是
A.①②③④
B.②③
C.①②④
D.②③④
(5)根据计算用托盘天平称取的质量为g.
(6)Ⅱ.若配制1mol/L的稀硫酸溶液500mL
则需要质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为mL(计算结果保留一位小数).如果实验室有10mL、25mL、50mL量筒,应选用mL规格的量筒最好.
(7)下面操作造成所配稀硫酸溶液浓度偏高的是
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com