
科目: 来源: 题型:
【题目】下列对有关实验寧实的说明或解释正确的是
A. 用坩埚钳夹住一小块用砂纸打磨过的铝箔在洒精灯上加热,铝熔化但不滴落,说明Al2O3的熔点高于Al
B. 向某溶液中先淌加Ba(NO3)2溶液,出现白色沉淀,再滴加稀硝酸,沉淀不溶解,说明原溶液中一定含有SO42-
C. 向新制氯水中加入少量NaHCO3固体,出现较多气体,说明HClO的酸性强于H2CO3
D. 向某溶液中先滴加KSCN溶液,溶液不变红,再滴加双氧水,溶液变红,说明原溶液中一定含有Fe2+
【答案】AD
【解析】A、加热打磨过后的铝箔,铝表面生成氧化铝薄膜,铝熔化说明铝熔点低,但铝不滴落,说明氧化铝熔点非常高,故A正确;B、溶液中也可能存在的SO32-,Ba2+与SO32-反应生成白色的BaSO3沉淀,SO32-有强还原性,再加硝酸,硝酸将BaSO3氧化为不溶于硝酸的BaSO4,所以无法判断原溶液中是否含有SO42-,故B错误;C、氯气与水反应生成盐酸和次氯酸,加入NaHCO3固体,产生CO2,只能说明氯水酸性强于H2CO3,并不能说明HClO酸性强于碳酸,故C错误;D、向溶液中先滴加KSCN溶液,溶液不变红,则证明溶液中不含Fe3+,再加双氧水,溶液变红,说明原溶液中一定含有Fe2+被双氧水氧化为Fe3+,故D正确。故选AD。
【题型】多选题
【结束】
21
【题目】某种制取纯碱的方法如下:
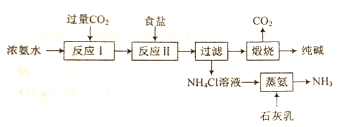
(1)写出“反应I ”的化学方程式:__。
(2)“反应Ⅱ”为复分解反应,反应中所涉及物质的溶解度如图所示。写出“反应Ⅱ”的化学方程式:__。

(3)写出“煅烧”反应的化学方程式:__。
(4) “蒸氨”时需要加热,写出“蒸氨”时反应的化学方程式:___。
(5)写出将“蒸氨”产生的氨气通入Al2(SO4)3溶液中时反应的离子方程式: __。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 标准状况下,22.4LCCl4中含有的碳原子数为6.02×1023
B. 常温常压下,32gO3中含有的分子数为2×6.02×1023
C. 1mol·L-1Al2(SO4)3中含有的铝离子数为2×6.02×10 23
D. 2molCl2与足量NaOH完全反应,转移电子数为2×6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某温度下,Ksp(AgCl)=1.56×10﹣10 , Ksp(Ag2CrO4)=1×10﹣12 . 下列关于该温度下的叙述正确的是( )
A.向氯化银的悬浊液中加入氯化钠溶液,Ksp(AgCl)减小
B.饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大
C.若向0.0008molL﹣1的K2CrO4溶液中加入等体积0.002 molL﹣1的AgNO3溶液,则CrO42﹣﹣完全沉淀
D.若将0.001molL﹣1AgNO3溶液滴入浓度均为0.001 molL﹣1的KCl和K2CrO4混合溶液中,则先产生AgCl沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语表示正确的是
A. NaH中H的化合价:-1
B. 小苏打的化学式:NaCO3
C. 氯离子的结构示意图
D. NaClO的电离方程式:NaClO=Na++Cl-+O2-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于化学电源的叙述错误的是( )
A.普通锌锰干电池中碳棒为正极
B.铅蓄电池中覆盖着PbO2的电极板是负极板
C.氢氧燃料电池的正极是通入氧气的那一极
D.碱性锌锰干电池的比能量和储存时间比普通锌锰干电池高
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液.下列说法正确的是( ) 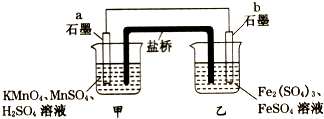
A.a电极上发生的反应为:MnO4﹣+8H++5e﹣═Mn2++4H2O
B.外电路电子的流向是从a到b
C.电池工作时,盐桥中的SO42﹣移向甲烧杯
D.b电极上发生还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,小明设计了如图所示的实验装置,按要求填空。

①请根据小明的意图,连接相应的装置,接口顺序: 接 , 接 , 接 。(填字母)____________
②U形管中所盛试剂的化学式为_____________;
③装置C中CCl4的作用是__________________;
④小红认为小明的实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,小红同学提出在某两个装置之间再加装置F。你认为装置F应加在____之间(填装置序号)。瓶中可以放入_______;
⑤小强看到小明设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成其他溶液。你认为可将溶液换成________,如果观察到________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室配制物质的量浓度均为0.2 molL-1的NaOH溶液和稀H2SO4各500mL。
提供的试剂是:NaOH固体和98%的浓H2SO4(密度为1.84 g/cm3)及蒸馏水。
(1)应用托盘天平称量NaOH__________g,应用10mL量筒量取浓H2SO4____________mL。
(2)配制两种溶液时都需要的仪器是__________。
(3)在配制上述溶液实验中,下列操作引起结果偏低的有_________________(填序号)
A、在烧杯中溶解溶质搅拌时,溅出少量溶液
B、没有用蒸馏水洗烧杯2—3次,并将洗液移入容量瓶中
C、定容时,仰视容量瓶刻度线以控制加水量
D、将所配溶液从容量瓶转移到试剂瓶时,有少量溅出
E、将浓硫酸在烧杯中稀释后,趁热转移进容量瓶进行后续配置步骤
F、容量瓶刚用蒸馏水洗净,没有烘干
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)2Z(g);△H<0,一段时间后达到平衡.反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )
A.0~2 min的平均速率v(Z)=2.0×10﹣3 molL﹣1min﹣1
B.其他条件不变,降低温度,反应达到新平衡前 v(正)<v(逆)
C.该温度下此反应的平衡常数K=144
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关反应热的叙述中正确的是( ) ①已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJmol﹣1 , 则氢气的燃烧热为△H=﹣241.8kJmol﹣1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)═Z(g)+W(s)△H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
④已知:
共价键 | C﹣C | C═C | C﹣H | H﹣H |
键能/(kJmol﹣1) | 348 | 610 | 413 | 436 |
上表数据可以计算出 ![]() (g)+3H2(g)→
(g)+3H2(g)→ ![]() (g)的反应热;
(g)的反应热;
⑤由盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1molCO2固体时,放出的热量相等;
⑥25℃,101kPa时,1mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热.
A.①②③④
B.③④⑤
C.④⑤
D.⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com